La medicina de precisión exige la estratificación de pacientes, identificar a los pacientes específicos que tienen mayores probabilidades de beneficiarse de la terapia; los diagnósticos complementarios también permiten tiempos reducidos de desarrollo y menores costos de desarrollo farmacológico, pueden dar como resultado reembolsos más beneficiosos e ilustrar la eficacia comparativa.
Una nueva opción, llamada diagnóstico complementario asociado con clases de fármacos, ofrece información adicional sobre cómo podría usarse un fármaco, pero es diferente de los diagnósticos complementarios que se asocian con un fármaco específico. Nosotros respaldamos el desarrollo de los dos primeros diagnósticos complementarios aprobados por la FDA asociados con clases de fármacos, y podemos ayudarle a sopesar sus opciones estratégicas.
Las necesidades que usted tiene en el ámbito terapéutico le exigen un compañero; usted necesita un socio hábil.
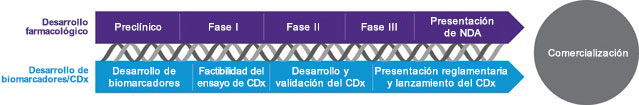
Un diagnóstico complementario (CDx) puede hacer realidad la promesa de la medicina personalizada. Gracias al respaldo de nuestro equipo de médicos y científicos expertos en todas las áreas terapéuticas, usted podrá encontrar una armonía entre sus objetivos de desarrollo de Rx y Dx. Juntos, en tándem con la aprobación de su terapia, le ayudaremos a que su CDx llegue al mercado más rápido.
La importancia de poder elegir: prueba in vitro o desarrollada en laboratorio.
Su mejor camino hacia la comercialización de su CDx puede que no involucre el kit de diagnóstico in vitro (DIV), que se distribuye normalmente. Los proyectos que incluyen fármacos huérfanos, tiempos reducidos o complejidades operativas pueden tener éxito con un ensayo hecho en laboratorio y aprobado por la FDA. Usted podrá minimizar la inversión inicial y mitigar los riesgos potenciales asociados con un kit de DIV de amplia distribución. Como su socio, desarrollaremos y validaremos su prueba, nos encargaremos de la presentación reglamentaria y le ofreceremos acceso global inmediato para que su prueba llegue al mercado rápidamente.
Independientemente de que esté dedicándose a una prueba desarrollada en laboratorio (LDT) o a un DIV, necesita la orientación de expertos para unir el desarrollo de su CDx y el desarrollo terapéutico y aprovechar sus ensayos al máximo. Dado que contamos con más de 25 años de experiencia en el ámbito de ensayos clínicos y que hemos lanzado al mercado más de 80 diagnósticos, tenemos el "arsenal" técnico y las perspectivas científicas que pueden ayudarle a determinar cuál es el mejor enfoque para la comercialización.