Date: July 2020
Póngase en contacto con el equipo científico de oncología para acceder a más información.
In February, we presented initial data of Labcorp's emerging humanized mouse platform utilizing human peripheral blood mononuclear cell (hPBMC) engraftment.
Our data using the NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ (NSG) mouse resulted in identification of four hPBMC donors that exhibited a treatment window of at least 30 days post hPBMC injection, consistent T cell engraftment, and growth of two human xenograft models, MiaPaCa-2 (pancreatic) and A549 (NSCLC), that was robust in hPBMC-engrafted NSG mice.
Ahora presentamos los datos de eficacia inicial que demuestran el uso de ratones NSG injertados con hPBMC y con xenoinjertos de MiaPaCa-2 o A549 tras el tratamiento con pembrolizumab (Keytruda®, anti-hPD-1).
Diseño experimental
El objetivo de estos estudios fue evaluar la respuesta antitumoral del pembrolizumab contra los modelos tumorales humanos MiaPaCa-2 o A549 tras el injerto de hPBMC en ratones NSG. Para el cuidado y uso de animales en instalaciones con acreditación de AAALAC, se siguieron las pautas de la Guía para el cuidado y uso de animales de laboratorio.
A ratones NSG (Jackson Laboratories, Bar Harbor Maine, EE. UU., variedad n.° 0005557) se les administró por vía intravenosa hPBMC de tres donantes sanos normales diferentes (Hemacare, Los Ángeles, CA, EE. UU.) una vez establecidos los tumores (~105-118 mm3). El tratamiento con pembrolizumab se inició el día después a la inyección de hPBMC. Response to pembrolizumab, evaluation of onset of Graft vs. Host Disease (GvHD)-like characteristics were determined, and whole blood was collected at two timepoints for flow cytometry analysis of human lymphocyte markers to confirm donor engraftment of CD45+ cells, including CD4+ and CD8+ T cells.
Crecimiento de tumor de control MiaPaCa-2 y A549 en ratones injertados con hPBMC
El tiempo de duplicación (Td) del tumor MiaPaCa-2 en los animales de control sin tratar fue de ~7 días, el Td en animales inyectados con hPBMC varió entre ~5 y 7 días en los grupos de cada donante.
Los tumores crecieron uniformemente hasta un volumen tumoral promedio de 1000-1200 mm3 para el día 36 entre los tres donantes; sin embargo, se vio cierta variabilidad intragrupo e intergrupo pasado el día 36. El crecimiento tumoral antes de los 1000 mm3 no parece haberse visto afectado por el injerto de hPBMC (imagen 1).
Estos resultados sugieren que la utilización de cualquiera de estos tres donantes sería apta para estudios de eficacia con MiaPaCa-2 con un tiempo hasta el tamaño de evaluación (TES) de 1000 mm3.
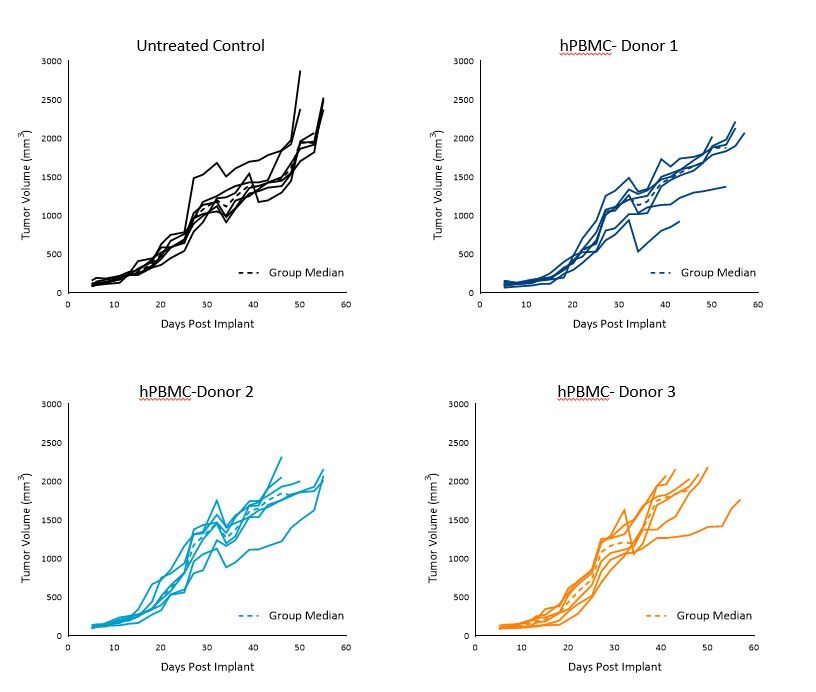
Imagen 1. Crecimiento de control de tumores subcutáneos MiaPaCa-2 tras administración de hPBMC
El Td de A549 en animales de control sin tratar fue de ~11 días, el Td en animales inyectados con hPBMC varió entre 9 y 12 días en los grupos de cada donante.
Los tumores crecieron uniformemente hPBMC de los donantes 1 y 3 hasta un volumen tumoral promedio de 1000-1200 mm3 para el día 40 con cierta variabilidad pasado el día 40.
La variabilidad intragrupo fue más evidente en aquellos ratones con tumores A549 y hPBMC del donante 2 (imagen 2).
These results suggest that donors 1 and 3 are most suitable for A549 efficacy studies with a TES of 1000mm3.
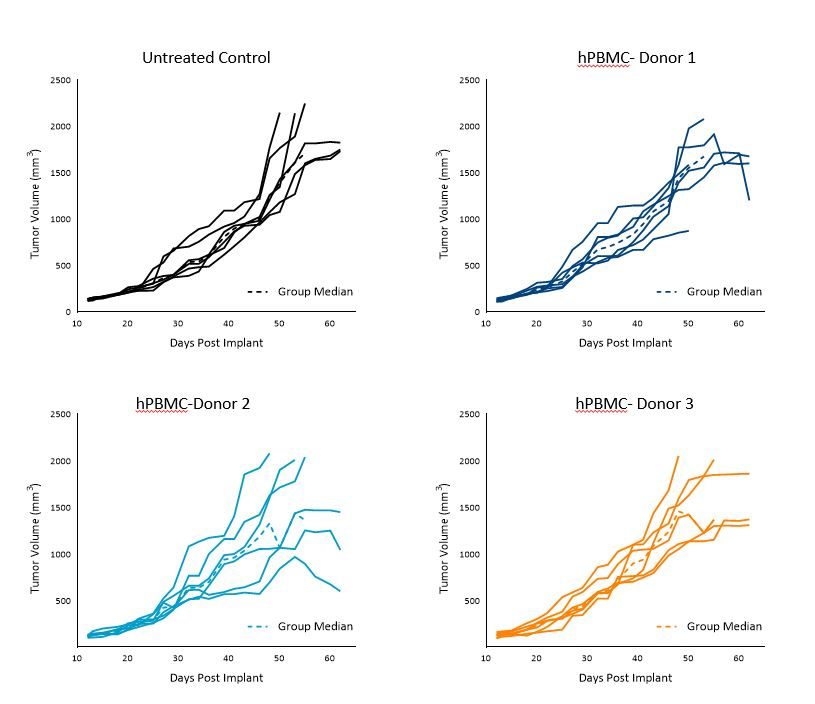
Imagen 2. Crecimiento de control de tumores A549 subcutáneos tras la administración de hPBMC
Injerto y persistencia de linfocitos humanos
El prendimiento se evaluó el día 28 y luego el día 38 (MiaPaCa-2) o el día 42 (A549) después de la administración de hPBMC mediante un análisis inmunofenotípico de marcadores de células inmunes humanas en la sangre periférica de ratones del estudio.
Los marcadores de citometría de flujo incluyeron mCD45, hCD45, hCD3, hCD4 y hCD8. Human CD45+ cells, as a percentage of live cells from animals harboring either MiaPaCa-2 (Figure 3A) or A549 tumors (Figure 3B), are presented below and were used as an indicator of hPBMC engraftment.
We found that hCD45+ cells in whole blood were detected across all donors at both timepoints and were in line with published literature.1
Si bien la variabilidad intragrupo fue evidente, la medida promedio de prendimiento se mantuvo consistente o aumentó entre el primer y el segundo punto temporal. Todo parece indicar que el prendimiento de hPBMC en animales con tumores A549 fue bastante mayor que el de las células injertadas en animales con tumores MiaPaCa-2, algo consistente con nuestros datos de desarrollo de modelo iniciales.
En este momento se desconoce si esto fue resultado de una variabilidad normal de estudio a estudio o si existe una dependencia del modelo con el prendimiento.
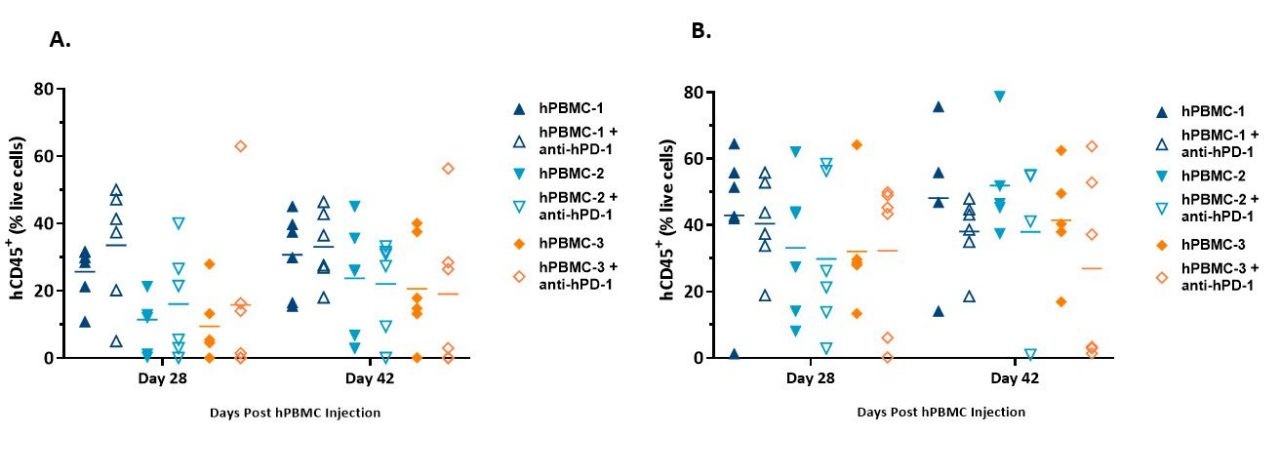
Imagen 3. Prendimiento de células hCD45+ detectado en sangre entera de ratones NSG inyectados con hPBMC y con xenoinjertos MiaPaCa-2 (A) o A549 (B).
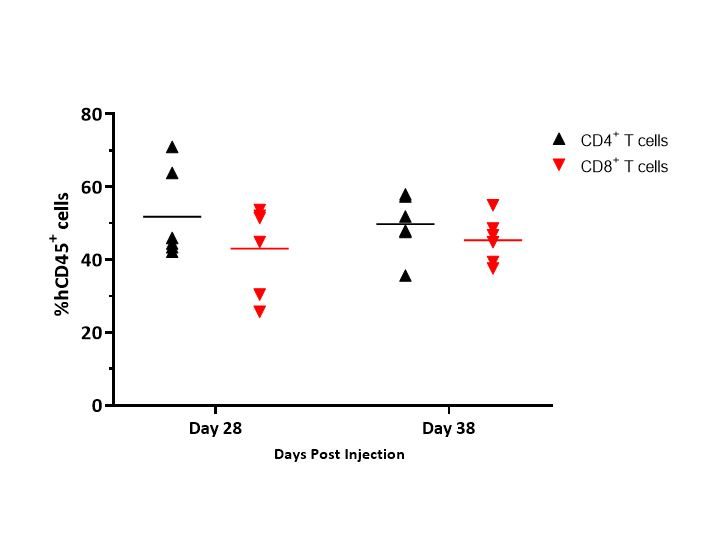
Figure 4 illustrates an example of distribution of CD4+ and CD8+ T cells in whole blood and illustrates that the distribution of T cells was consistent between timepoints.
Si bien estos datos solo representan al donante 1 en ratones con tumores MiaPaCa-2, se reportaron datos similares para todos los donantes y modelos estudiados.
Specifically, distribution of CD4+ and CD8+ T cells ranged from 42-65% and 32-46%, respectively, in MiaPaCa-2-bearing mice, and 51-67% and 22-44%, respectively, in A549-bearing mice (data not shown).
Onset of GvHD symptoms was monitored by body weight and clinical observations; though not confirmed pathologically in these studies, symptoms observed in these models are strongly correlated with the disease2 and with previous data (data not shown).
Respuesta a pembrolizumab
Resulta interesante que el tratamiento con pembrolizumab en los ratones injertados con hPBMC no afectó el crecimiento tumoral de MiaPaCa-2 ni A549 con ninguno de los donantes bajo las condiciones probadas (imágenes 5 y 6).
Al momento de la redacción de este artículo, había muy poca literatura sobre la respuesta in vivo a pembrolizumab en ratones humanizados injertados con hPBMC con tumores MiaPaCa-2.
Notwithstanding, our data is reflective of a wide literature regarding the refractory nature of pancreatic tumors to immuno-oncology agents.3 Response of pembrolizumab against A549 appears moderate as reported previously, and that response seems to be donor dependent.4
A pesar de la consistente falta de respuesta del pembrolizumab contra A549 o MiaPaCa-2, estos modelos pueden resultar útiles para enfoques terapéuticos usando estrategias de combinación racional con anti-hPD-1 ya que existen amplias posibilidades para mejorar y evaluar las respuestas variadas entre distintos donantes.
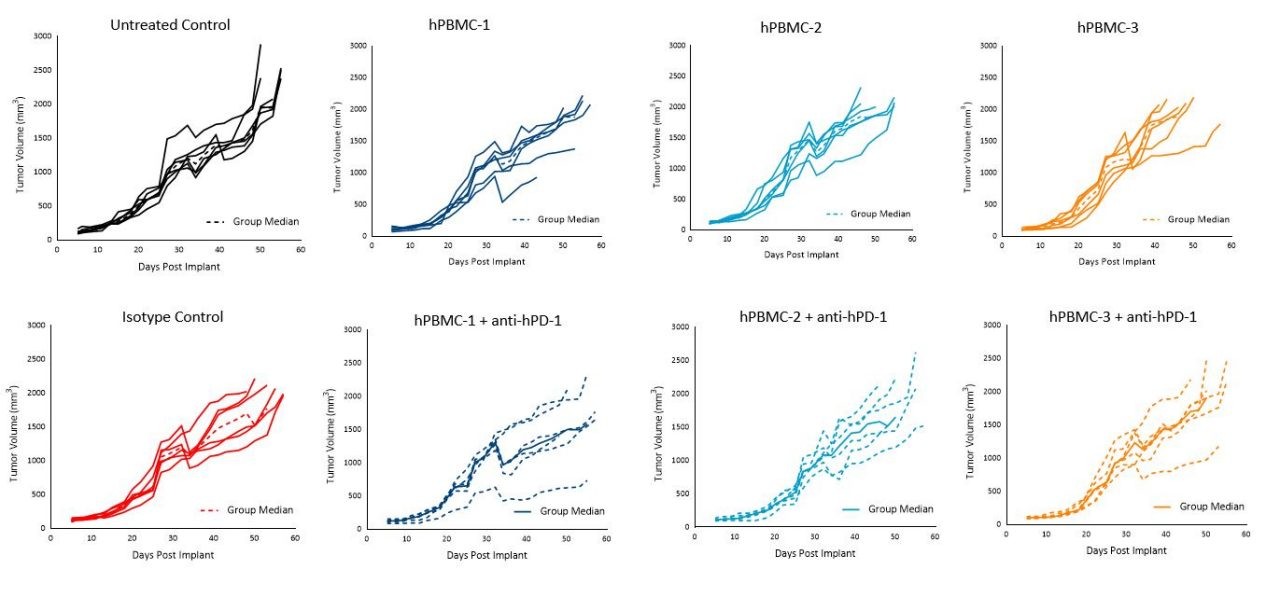
Imagen 5. Crecimiento tumoral de tumores subcutáneos MiaPaCa-2 tras administración de hPBMC y tratamiento con control de isotipo o pembrolizumab (anti-hPD-1)
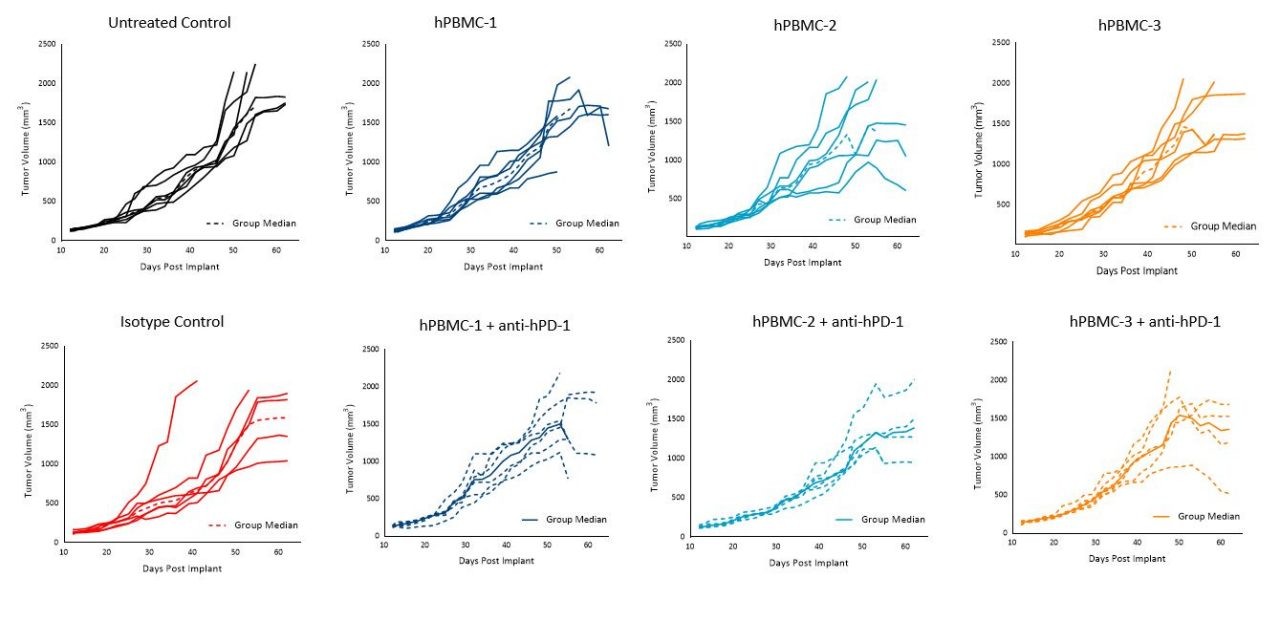
Imagen 6. Crecimiento tumoral de tumores subcutáneos A549 tras administración de hPBMC y tratamiento con control de isotipo o pembrolizumab (anti-hPD-1)
La administración de hPBMC a ratones NSG resulta en la persistencia de células T humanas en los ratones con efectos mínimos en el crecimiento tumoral de MiaPaCa-2 o A549. Este método representa una sólida plataforma preclínica para examinar los efectos de nuevos agentes humanos que aprovechan los linfocitos T humanos para dirigir la actividad antitumoral con una importancia clínica directa.
Con trabajos futuros se demostrará la infiltración de células T humanas en el tumor y periferia por citometría de flujo con tratamiento de inmunoterapias aprobadas por la FDA contra xenoinjertos tumorales humanos en ratones NSG reconstituidos con hPBMC.
Labcorp has banked supplies of these human PBMC donors to be available for your research needs. Please contact our preclinical oncology scientists to see how hPBMC-engrafted NSG mice can be used for your next translational immuno-oncology study.
Referencias
1.Todd Pearson, Dale L. Greiner y Leonard D. Shultz. "Creation of "Humanized" Mice to Study Human Immunity". 2008. Current Protocols in Immunology, capítulo 15: unidad 15,21
2.Sina Naserian, Mathieu Leclerc, Allan Thiolat, Caroline Pilon, Cindy Le Bret, Yazid Belkacemi, Sébastien Maury, Frédéric Charlotte y José L. Cohen. "Simple, Reproducible, and Efficient Clinical Grading System for Murine Models of Acute Graft-versus-Host Disease". 2018. Front. in Immun. (9): 10.
3.Robert J. Torphy, Yuwen Zhu y Richard D. Schulick. "Immunotherapy for pancreatic cancer: Barriers and breakthroughs". 2018. Ann Gastroenterol Surg. 2(4): 274-281.
Conéctese
Conversemos
Contáctenos