Date: September 2018
El cáncer de ovario se considera una neoplasia ginecológica relativamente poco común pero tiene una de las tasas de mortalidad más elevadas debido a los síntomas no específicos que se presentan en los primeros estadios de la enfermedad. Como consecuencia, la mayoría de las mujeres reciben un diagnóstico cuando la enfermedad está en las etapas más avanzadas. La incidencia del cáncer de ovario dentro de Estados Unidos es de aproximadamente 22.000 casos por año y produce alrededor de 14.000 muertes por año.
Si bien se han logrado varios avances en los tratamientos contra el cáncer y los métodos quirúrgicos, los pequeños progresos en las terapias contra el cáncer de ovario han tenido un impacto significativo en esta población de pacientes. Aunque las respuestas iniciales pueden ser altas, más del 80% de las pacientes sufren una recaída después de las terapias de primera línea y más del 50% de estas mujeres mueren dentro de los 5 años posteriores al diagnóstico.
Las opciones limitadas de segunda línea en pacientes que presentan resistencia al tratamiento de primera línea junto con el diagnóstico en etapas tardías de la enfermedad contribuyen a la baja sobrevida total y convierten esta enfermedad en una necesidad médica altamente insatisfecha que ha sido un área de investigación activa para el hallazgo de fármacos oncológicos. El éxito reciente con inmunoterapias para otros cánceres da un poco de esperanza a los pacientes con cáncer de ovario. Uno de los datos más prometedores indica que la presencia de linfocitos infiltrantes de tumor tiene una correlación positiva con una mejor sobrevida en pacientes con cáncer de ovario.[1]
Modelo de carcinoma de ovario murino ID8 para el uso como modelo singeneico preclínico
At Labcorp we have established the ID8 murine ovarian carcinoma model as a preclinical syngeneic model that can be used to track and monitor disease progression and therapeutic outcomes. Nuestro modelo se basa en la administración intraperitoneal de células ID8 con expresión de luciferasa para imitar aspectos de la enfermedad en humanos. Tras el implante in vivo, las células ID8-demuestran un tiempo de duplicación tumoral de 7 a 8 días y un promedio de sobrevida total de aproximadamente entre 40 y 50 días. No se observó pérdida de peso corporal a lo largo del tiempo en este modelo. Sin embargo, es común el aumento de peso debido a la acumulación de ascitis peritoneal asociada a las fases tardías de la enfermedad (figuras 1A, B, C).
Fig. 1: evaluación in vivo del modelo ID8-luc en ratones C67BL/6 a lo largo del tiempo
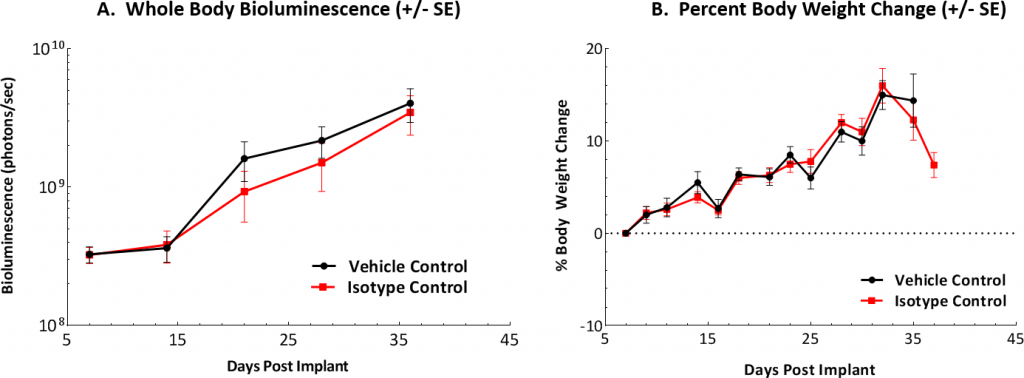
Fig. 1A: representación gráfica de la carga tumoral que se encuentra en ratones de control tras el implante de IP.
Fig. 1B: se midieron los pesos corporales tres veces por semana y se muestra el porcentaje de cambio desde el día del implante (día 0).
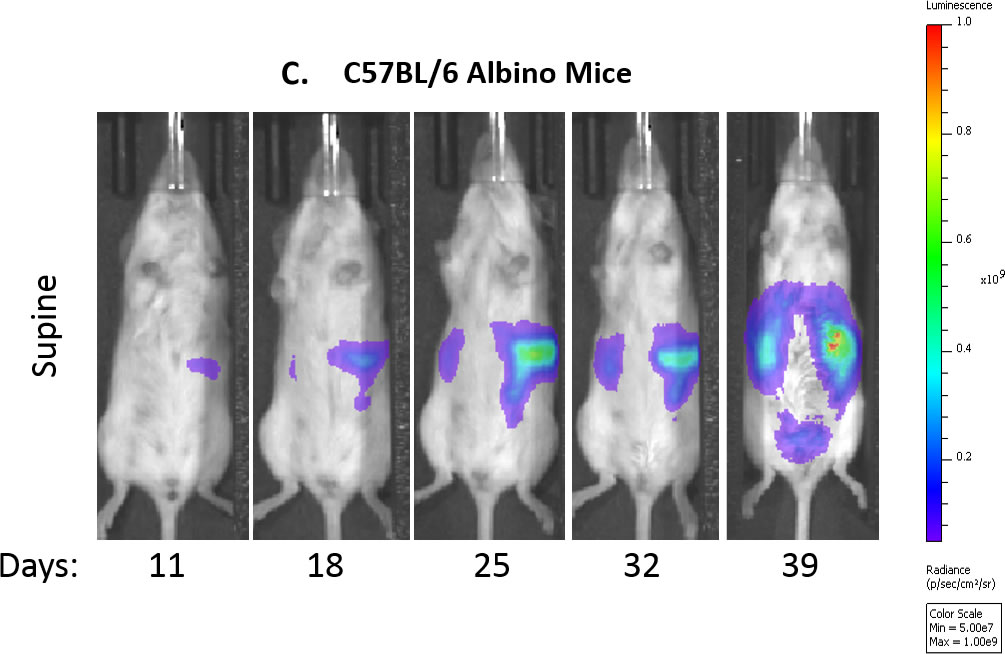
Fig. 1C: imágenes representativas por bioluminiscencia de un ratón de control a lo largo del tiempo.
Evaluación de inmunofenotipo del líquido ascítico
Las observaciones clínicas incluyen distensión abdominal debido a la acumulación de ascitis en etapas más avanzadas de la enfermedad. Al momento de la necropsia, se observan nódulos tumorales sólidos dentro de la cavidad peritoneal, que incluye el páncreas, el hígado, el bazo y la pared abdominal.
Comprender el perfil de células inmunitarias de los modelos singeneicos es un aspecto fundamental en la elección de un modelo. Por lo tanto, evaluamos el immunofenotipo del líquido ascítico (figuras 2A, B, C) y hallamos un gran porcentaje de células B, células supresoras derivadas mieloides de granulocitos (G-MDSC) y células macrófagas asociadas a tumores (TAM) M1 y M2. Se está tratando de evaluar mejor los nódulos tumorales sólidos observados.
Fig 2: inmunotipificación de ascitis en ratones con implante de ID8-luc
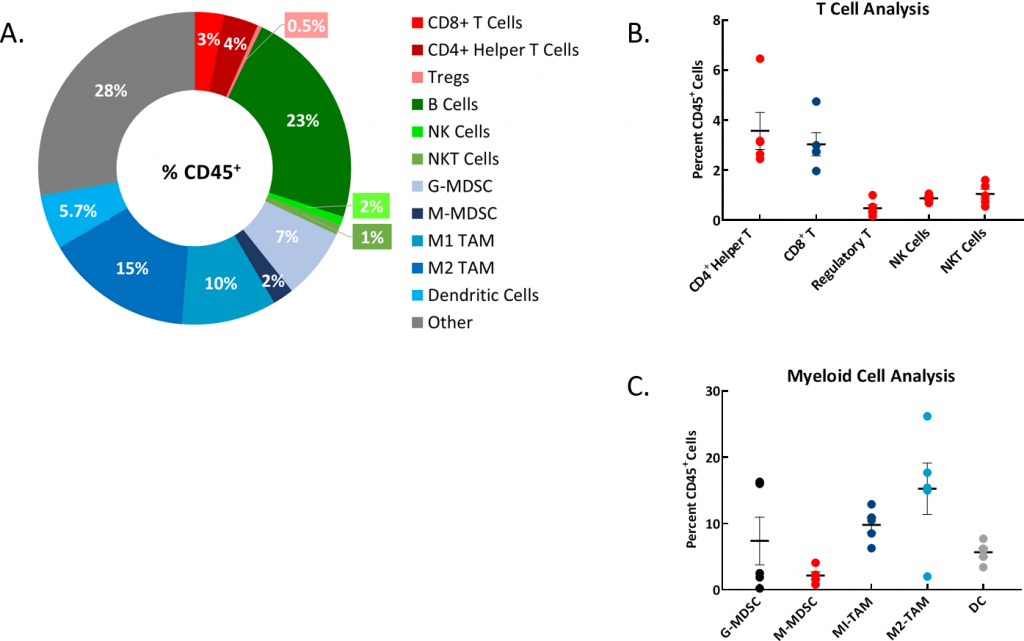
Fig. 2A: gráfico de dona representativo que muestra la distribución de las poblaciones de células inmunitarias como porcentaje de la población total de CD45+.
Fig 2B: análisis de poblaciones de células T.
Fig. 2C: análisis de poblaciones de células mieloides. Estudio llevado a cabo con muestras de ascitis en n=5 ratones individuales.
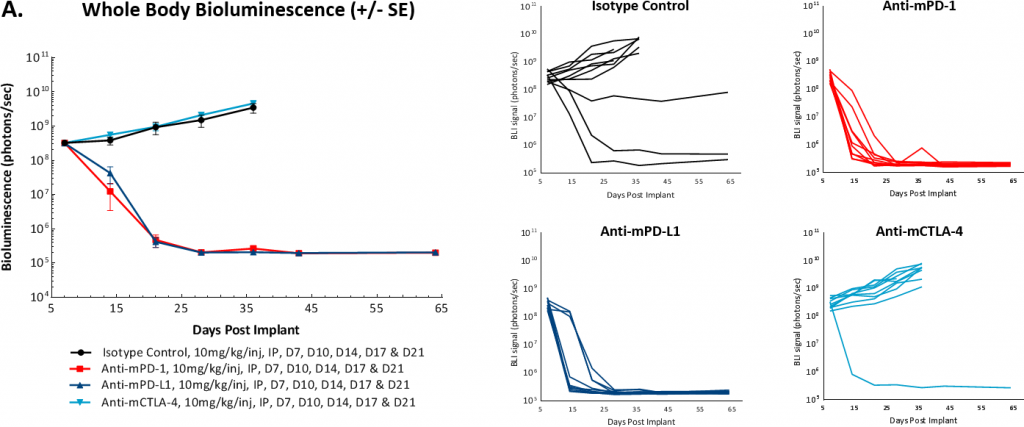
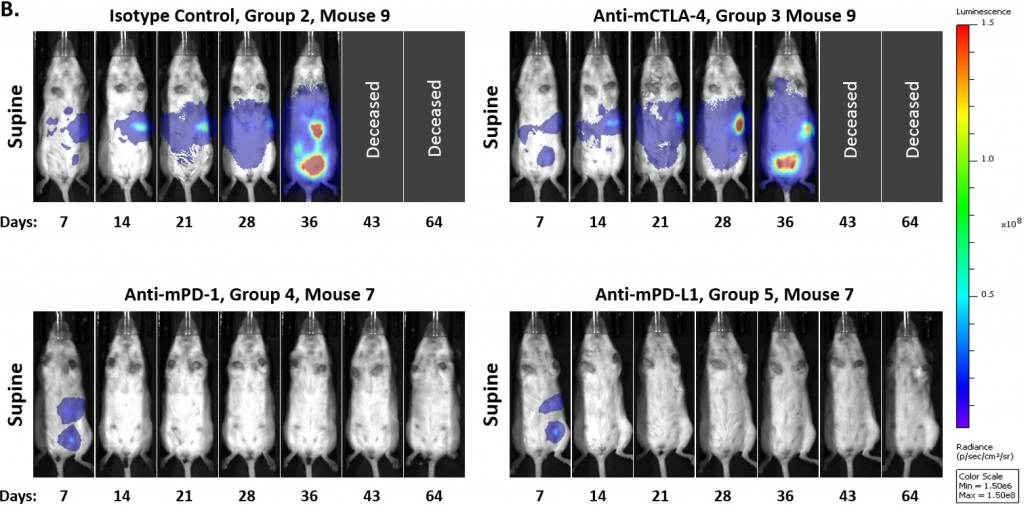
Para determinar si el modelo presentaba una respuesta a la inhibición de puntos de control inmunitario, analizamos los anticuerpos anti-mPD-1, anti-mPD-L1 y anti-mCTLA-4 a partir de 7 o 14 días luego del implante de células tumorales. Al igual que con muchos modelos tumorales singeneicos sólidos, descubrimos que la respuesta a estas terapias variaba según el momento del inicio del tratamiento. En las figuras 3A y 3B, mostramos que el inicio del tratamiento con anticuerpos anti-mPD-1 o anti-mPD-L1 7 días después del implante de células tumorales generó una regresión completa de los tumores, por lo cual es una etapa inadecuada para el uso de fármacos combinados. En cambio, el modelo mostró resistencia al tratamiento con anti-mCTLA-4. Asimismo, observamos que un pequeño porcentaje de los tumores de control retrocedieron espontáneamente cuando se inició el estudio en el día 7.
Fig 3: ID8-luc intraperitoneal: señal promedio e individual de BLI de cuerpo entero a lo largo del tiempo
En un estudio de seguimiento, demoramos el inicio del tratamiento a 14 días luego del implante de células tumorales y no observamos una regresión espontánea de los tumores de control. También observamos una modulación de la tasa de respuesta total de las terapias con anti-mPD-1 o anti-mPD-L1. Sin embargo, aún pareció que estos anticuerpos produjeron una respuesta al tratamiento de "todo o nada". Además, la reducción de la dosis de anticuerpos de 10 mg/kg a 5 mg/kg no generó consecuencias materiales en la actividad antitumoral de estos agentes (Figure 4). Los trabajos futuros evaluarán un mayor retraso en la dosis de anticuerpos para determinar si podemos seguir reduciendo la actividad de agentes individuales de estos inhibidores de puntos de control.
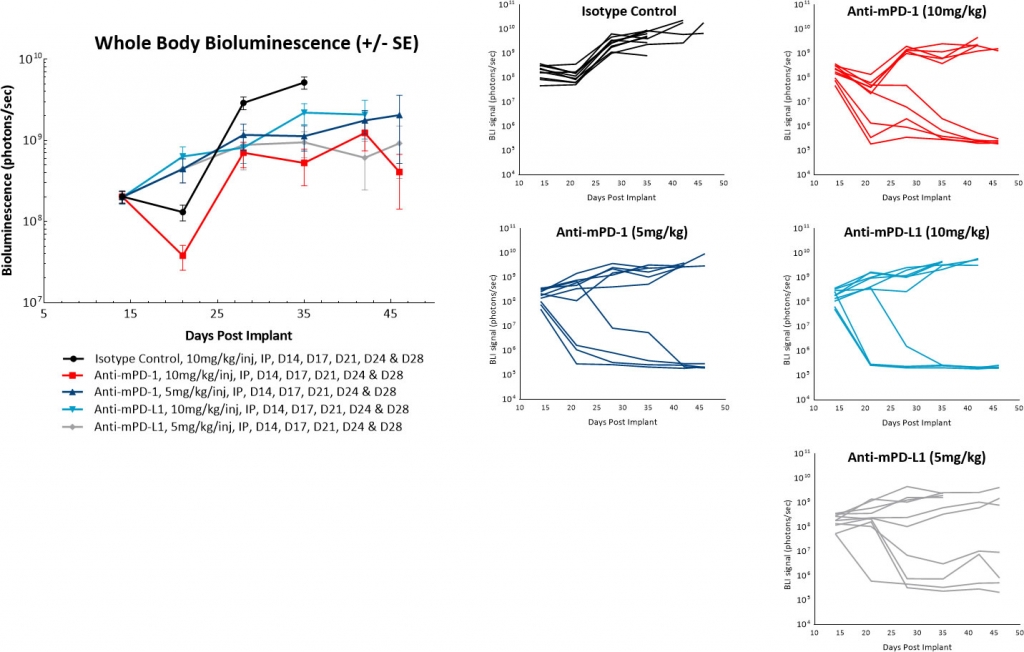
Tabla 1: líneas celulares de cáncer de pulmón
Vea nuestra curva de crecimiento del A549:
A549: carcinoma pulmonar en humanos
Labcorp has multiple lung cancer cell lines available for use (Table 1). Please contact us to run your next lung cancer study.
Fig 4: ID8-luc intraperitoneal: señal promedio e individual de BLI de cuerpo entero tras el tratamiento con anticuerpos inhibidores de puntos de control
Referencias
Conéctese
Conversemos
Contáctenos