Date: July 2017
El adenocarcinoma ductal de páncreas (ADP) es la forma de cáncer de páncreas más común y representa alrededor del 95% de todos los casos. En 2017, se diagnosticará ADP a aproximadamente 50.987 personas en Estados Unidos y morirán aproximadamente 40.936 pacientes, por lo cual se considera que el ADP es una de las formas de cáncer más letales. El tratamiento estándar en EE. UU. es la quimioterapia combinada con taxanos antimetabolitos y antimitóticos, pero históricamente estas opciones de tratamiento solo mejoran la sobrevida total en algunas semanas. Hay una necesidad médica insatisfecha fundamental de enfoques terapéuticos novedosos para tratar el cáncer de páncreas.
Como tantos enfoques novedosos para el tratamiento de cáncer de páncreas han tenido resultados clínicos desalentadores, muchos científicos de descubrimiento de fármacos han recurrido a la inmunoterapia en cáncer de páncreas debido al éxito reciente al aprovechar el sistema inmunológico para tratar otros tipos de cáncer. Although there are a limited number of syngeneic mouse pancreatic cancer cell lines, Labcorp has characterized the Pan02 PDAC model for immuno-oncology applications. El modelo Pan02 se derivó de ratones C57BL/6 a los cuales se administró 3-metilcolantreno ortotópico y es resistente a muchos agentes quimioterapéuticos estándar.1 El Pan02 contiene una mutación de pérdida de función en el gen SMAD4 que es funcionalmente similar a las mutaciones inactivadoras en aproximadamente el 30% de los cánceres pancreáticos humanos.2
Curvas de crecimiento promedio e individual
Labcorp maintains Pan02 as a transplantable fragment model, and its mean growth kinetics (Figure 1A) and individual animal growth curves (Figure 1B) are illustrated. El Pan02 tiene un tiempo de duplicación tumoral de seis días, que es más lento que la mayoría de los tumores de líneas celulares de ratones singeneicos. Este crecimiento más lento puede hacer que sea más tratable a través de la inmunoterapia, ya que hay tiempo para que las terapias modifiquen el sistema inmunológico y produzcan actividad antitumoral antes de que los tumores alcancen los criterios de eutanasia.
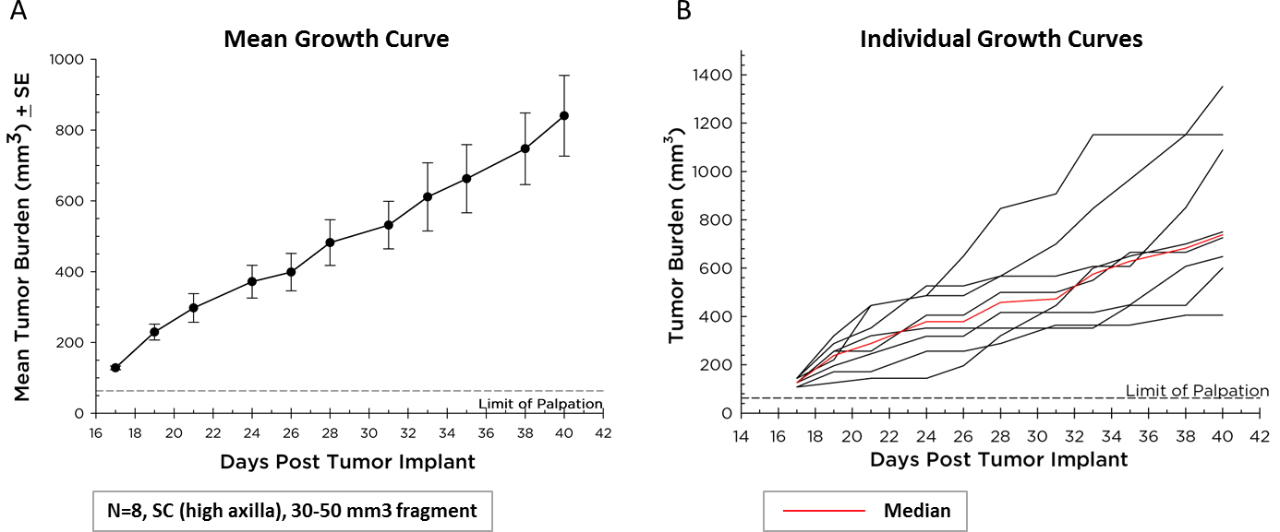
Fig. 1 (A y B): crecimiento del cáncer pancreático Pan02 en ratones C57BL/6
Tasas de eficacia y sobrevida con anti-PD-1 y anti-CTLA-4
Actualmente, los anticuerpos inhibidores de puntos de control de células T contra el CTLA-4, PD-1, y PD-L1 están aprobados en casos de cáncer no pancreático. Probamos el anti-CTLA-4 (clon 4F10) y anti-PD-1 (clon RMP1-14), por separado y en combinación, en el modelo Pan02. Se inició la dosificación tres días después del implante y el promedio de carga tumoral grupal no ilustra una actividad significativa en ninguno de los grupos 2A). A menudo sucede que las inmunoterapias presentan actividad únicamente en un subgrupo de animales en tratamiento; por lo tanto, los gráficos de animales individuales son valiosos para detectar esas respuestas. Sin embargo, los gráficos de animales individuales no presentan ninguna actividad significativa con los agentes de prueba que no se observe también en el grupo de control (figura 2B). Además, tal como se esperaba por los datos de respuesta en el crecimiento, no hay mejoras en la sobrevida de los grupos en tratamiento en comparación con los grupos de control (figura 3).
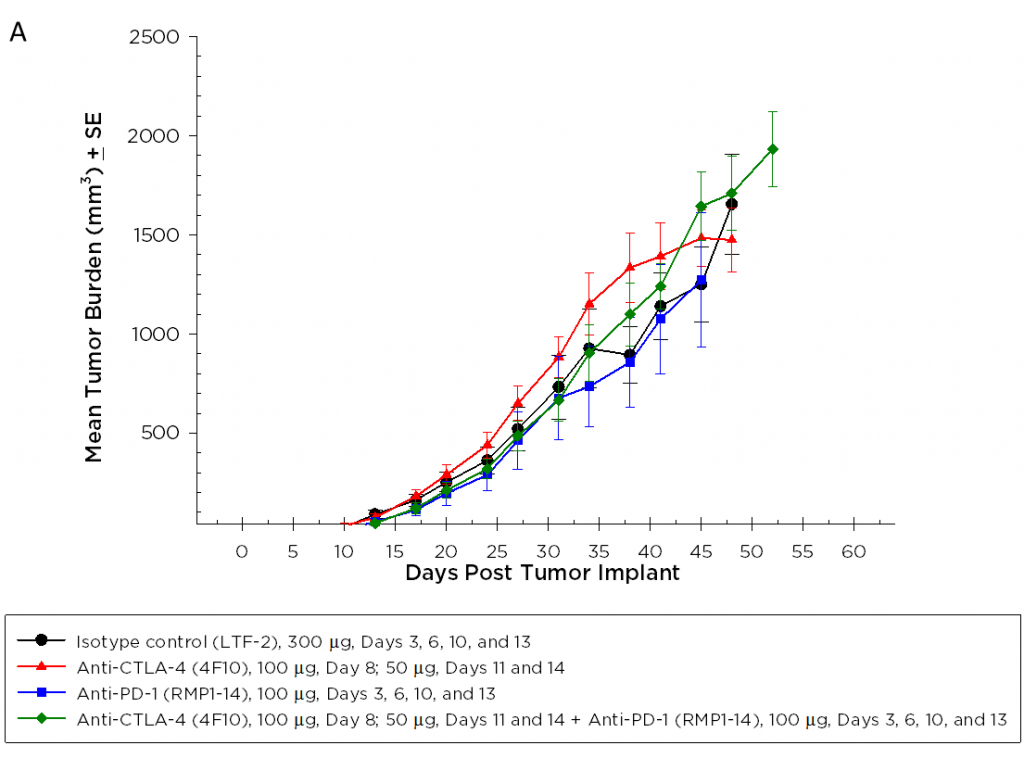
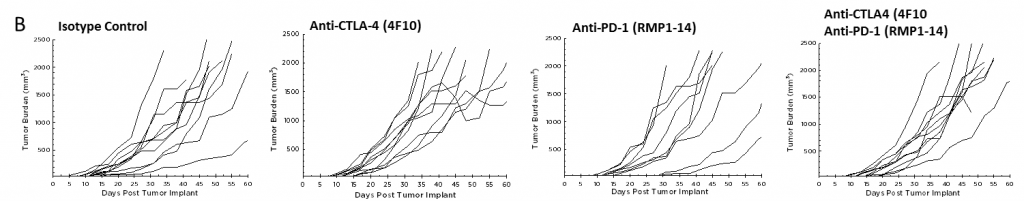
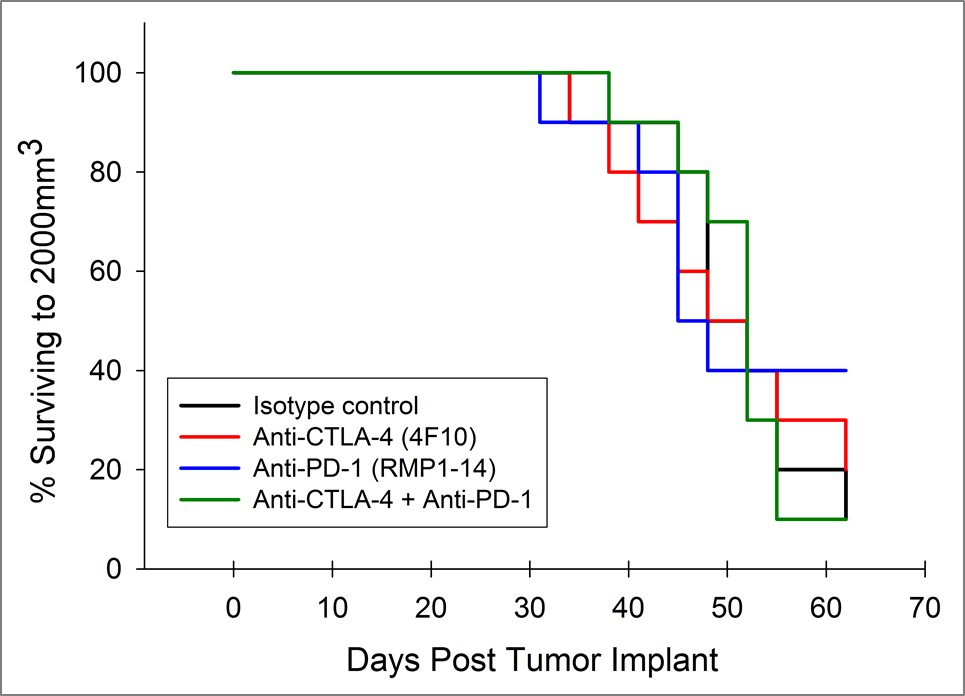
Fig. 3: sobrevida de ratones con tumores pancreáticos Pan02 tratados con anti-PD-1 y anti-CTLA-4
Perfiles inmunológicos
Queríamos determinar si los inhibidores de puntos de control tuvieron un impacto en la infiltración de células inmunitarias en los tumores Pan02. En la figura 4, se muestran los perfiles inmunológicos de leucocitos CD45+, células T CD4+, células T CD8+, células T reguladoras (Treg), células supresoras derivadas mieloides de monocitos (M-MDSC) y MDSC de granulocitos (G-MDSC) totales.
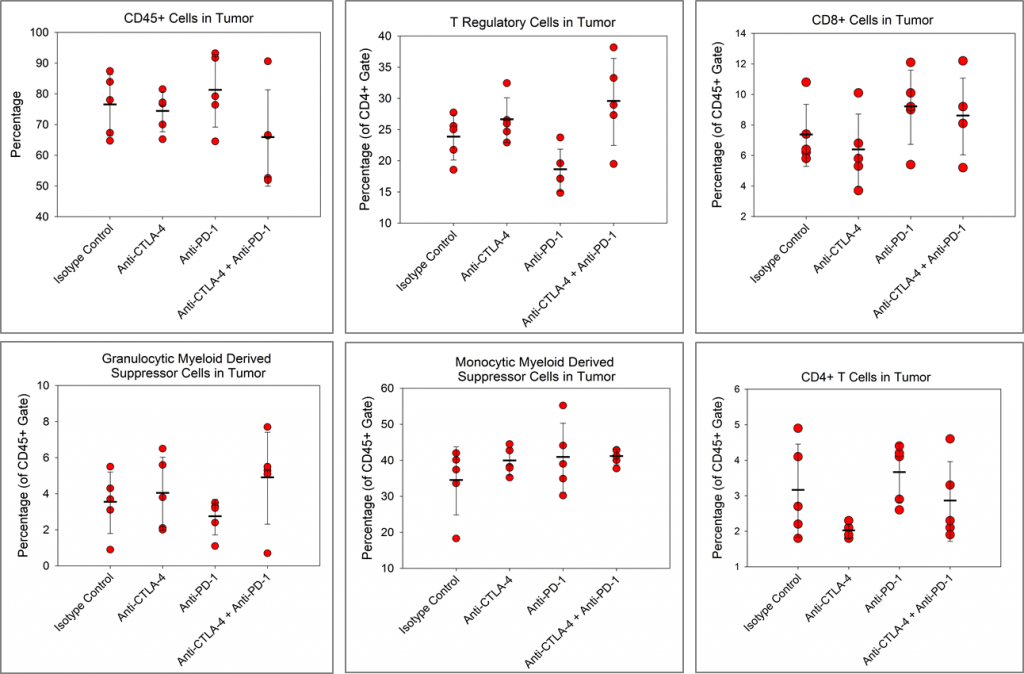
SI bien hay una tendencia hacia una reducción de células T CD4+ en el grupo tratado con anti-CTLA-4 y una tendencia hacia una reducción de células T reguladoras en el grupo tratado con anti-PD-1 que se relacionan con el control de isotipo, no se observan otros cambios inmunológicos. Aunque los inhibidores de puntos de control por sí solos no tienen actividad aparente en el modelo Pan02, hay informes publicados sobre la actividad de inhibidores de puntos de control en tumores Pan02 con radiación3 o un anticuerpo agonista coestimulador anti-CD40,4 Es importante destacar que el anti-PD-L1 mostró una fuerte sinergia con el anti-CD40 y la radiación en esos estudios, lo que indica que, si bien los tumores Pan02 son resistentes a inhibidores de puntos de control de agente individual, la inhibición de puntos de control puede promover la actividad de agentes combinados.
Contact us to speak with one of our scientists to see how Pan02 or one of our other syngeneic models can be used for your next immuno-oncology study.
Referencias
2Wang Y et al., Genomic Sequencing of Key Genes in Mouse Pancreatic Cancer Cells. 2012. Curr Mol Med. Vol. 12(3): 331–341.
3Azad A et al., PD-L1 blockade enhances response of pancreatic ductal adenocarcinoma to radiotherapy. 2017. EMBO Mol Med. Vol 9: 167–180.
Conéctese
Conversemos
Contáctenos