Date: October 2020
With the development of increasingly complex immunotherapies, biotech/pharma companies are now looking for more relevant and accurate preclinical tumor models to predict precise drug responses.
Si bien los estudios oncológicos preclínicos apuntan a simular enfermedades humanas en un entorno animal, el mayor reto que enfrentan los investigadores es la capacidad de traducir los resultados. Un modelo tumoral preclínico ideal no solo emplearía el subtipo de cáncer específico, sino que además simularía el complejo microambiente requerido para la tumorigénesis.
Varias publicaciones recientes han demostrado que el sitio donde se implanta el tumor puede afectar parámetros críticos como la cinética, vascularización, arquitectura, entorno hipóxico y sensibilidad del tumor a tratamientos antitumorales1-4.
Los modelos subcutáneos (SC) que se usan con mayor frecuencia tienen la ventaja de monitorear las medidas tumorales por calibre. Sin embargo, difieren de los tumores viscerales en morfología, densidad de vasos, infiltrados de células inmunes y microambiente tumoral. Esto es precisamente lo que intenta capturar un modelo tumoral ortotópico (OT), es decir: la implantación de líneas celulares tumorales o xenoinjertos derivados de pacientes en el órgano que coincide con el tipo de tejido.
En el contexto específico de la inmunoterapia, los datos publicados han demostrado que los modelos tumorales OT sin inmunosupresores con mayor abundancia de macrófagos y pueden ser menos sensibles a ciertos tipos de inmunoterapias que el mismo modelo implantado subcutáneamente2.
Para explorar el potencial de los modelos OT de proporcionar un microambiente tumoral más relevante y a la vez actuar como la ubicación principal del tumor en comparación con sus contrapartes SC, hemos activado varias líneas celulares singeneicas con luciferasa para poder hacer un monitoreo no invasivo de la progresión y metástasis tumoral.
En este artículo sobre modelo destacado presentamos el desarrollo del modelo Pan02-Luc, la línea celular de adenocarcinoma pancreático murino. Nota: todo el trabajo en animales contó con la aprobación del Comité Institucional de Uso y Cuidado Animal del centro y se realizó conforme a la Guía para el cuidado y uso de animales de laboratorio dentro de un programa acreditado por la AAALAC. Los criterios de eutanasia humanitaria se determinaron previamente basados en el peso corporal y observaciones clínicas definidas.
Desarrollo del modelo Pan02-Luc: la línea celular de adenocarcinoma pancreático murino
La implantación quirúrgica de células Pan02-Luc en la cabeza del páncreas en ratones C57BL/6 tuvo como resultado un prendimiento tumoral del ~100% y un crecimiento tumoral parejo con un tiempo de duplicación promedio de ~6 días según se determinó mediante imagenología por bioluminiscencia (BLI). Los animales tuvieron un tiempo de supervivencia promedio (morbilidad/mortalidad) relativamente prolongado de 58 días, lo que permite trabajar con 5 a 6 semanas de dosificación y evaluación de eficacia en este modelo (imagen 1). El prendimiento y progresión tumoral no tuvieron ningún efecto adverso en los pesos corporales y la observación clínica más común que condujo a la eutanasia fue la distensión abdominal (los datos no se muestran).
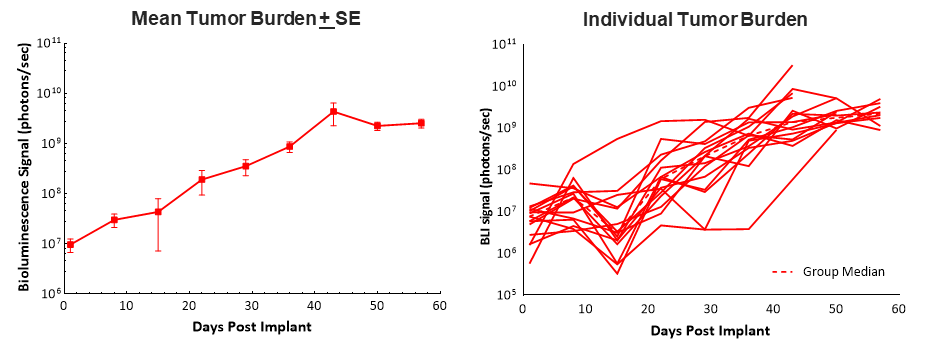
Se sabe bien que los cánceres pancreáticos se consideran tumores "fríos" y no responden bien a inmunoterapias. Por lo tanto, probamos el inhibidor de puntos de control anti-mPD-1 solo y en combinación con gemcitabina.
La evaluación de eficacia tras el tratamiento con anti-mPD-1 (10 mg/kg) no mostró ninguna respuesta significativa (imagen 2). El resultado del tratamiento con el estándar de atención relevante clínicamente con el agente de quimoterapia gemcitabina (50 mg/kg) en la regresión tumoral total (CR) en un 87% (7/8) de los animales y un 62% (5/8) se consideraron sobrevivientes libres de tumor (TFS) según se determinó por BLI. Se observó un nuevo crecimiento en dos animales tras la finalización del tratamiento. La combinación de gemcitabina con anti-mPD-1 no dio como resultado ningún TFS adicional en comparación con la administración de gemcitabina como único agente. Imágenes por bioluminiscencia representativas (imagen 2C) e imágenes de histología (imagen 2D) de tumores tomadas finalizado el estudio confirman la regresión tumoral en los grupos tratados con gemcitabina.
Imagen 2. Respuesta de Pan02-Luc a tratamientos con anti-mPD-1 y gemcitabina
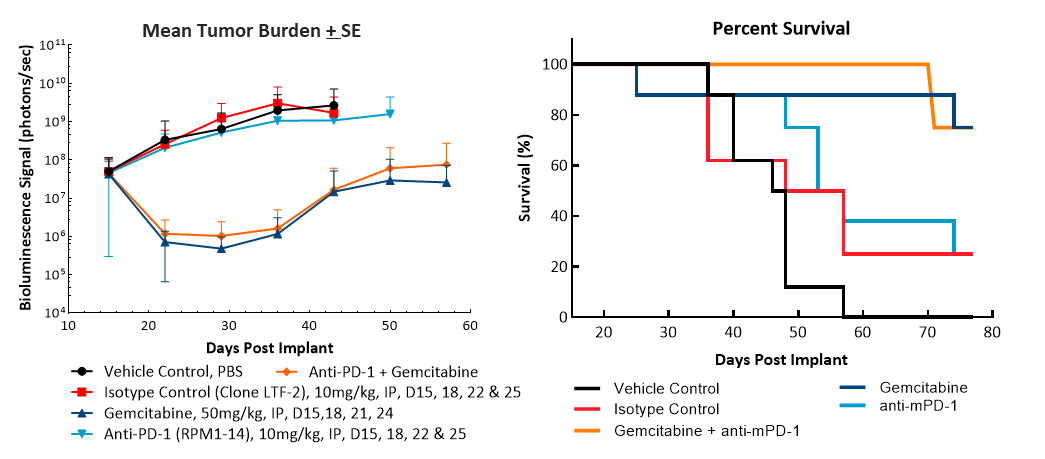

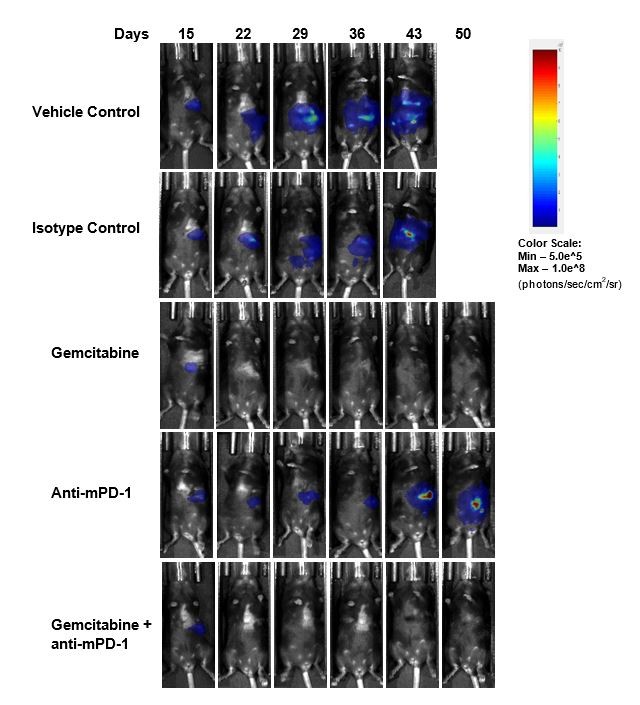
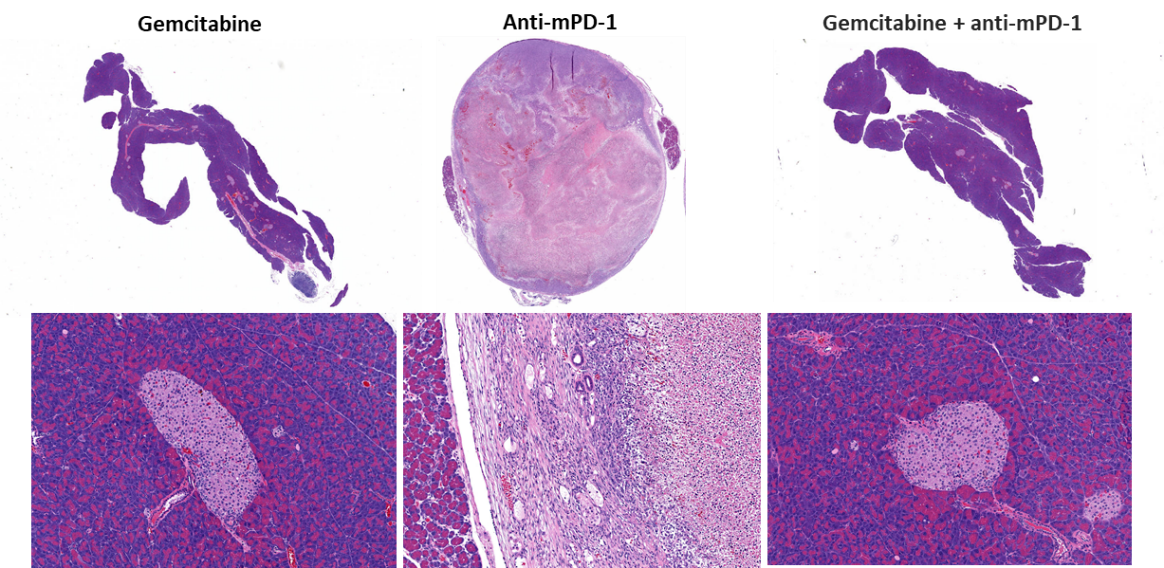
Ya hemos publicado artículos sobre la respuesta del modelo Pan02 subcutáneo a la inmunoterapia (ver este artículo destacado sobre modelo anterior). Por lo tanto, en una comparación de los datos de OT mostrados aquí con la línea celular Pan02 con luciferasa, observamos que la respuesta a anti-mPD-1 en el modelo OT fue similar a la del modelo Pan02 matriz SC. La respuesta a la gemcitabina, administrada con la misma concentración de dosis, fue significativamente mayor en el modelo OT que en el modelo SC donde los animales exhibieron un retraso en el crecimiento tumoral y una regresión parcial (RP) del 80%, RP del 20% y ningún TFS (cuadro 1).
Cuadro 1. Comparación de respuesta del tumor Pan02 SC y OT al tratamiento con gemcitabina
La infiltración de células inmunes en los tumores OT se evaluó por citometría de flujo, que confirmó la baja infiltración de células linfoides característica de un modelo tumoral no inmunogénico o "frío" (imagen 3A-B). Mientras que las células T colaboradoras CD8+ y CD4+ constituyeron solo el 1,6% y 1% de la población de CD45+, respectivamente, las poblaciones de células mieloides inmunosupresoras estuvieron presentes en abundancia con células supresoras derivadas mieloides de monocitos (CSDM-M) y macrófagos asociados al tumor M1 y M2 (MAT) siendo las subpoblaciones celulares dominantes. La comparación de los perfiles inmunes del modelo OT y el modelo SC demostró que las células T reguladoras), células exterminadoras naturales (NK) y células T exterminadoras naturales (NKT) se redujo significativamente en tumores OT. La población mieloide, en general, fue mayor en tumores OT constituyendo hasta un 82% de las células CD45+, con un 68% en el modelo SC. Las CSDM granulocíticas y MAT M2 fueron significativamente más elevados en tumores OT mientras que las células dendríticas fueron menores y un indicio de un fenotipo inmunosupresor más antiinflamatorio.
Imagen 3. Análisis por citometría de flujo de tumores SC y OT
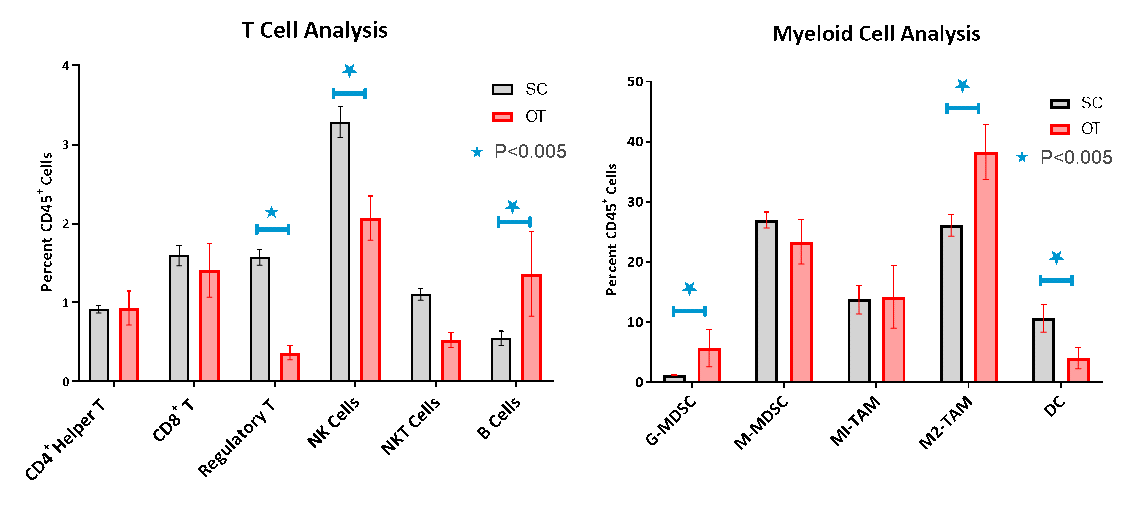
En nuestras manos, estas diferencias sutiles entre los modelos SC y OT pueden servir para analizar la intensidad de respuesta a los tratamientos que hemos investigado. Se ha reportado que estas diferencias son clínicamente críticas ya que influyen en la predecibilidad de respuesta y pronóstico en pacientes con cáncer pancreático5-7.
La implantación de tumores ortotópicos ofrece un modelo de progresión del cáncer y respuesta a fármacos en una manera que simula mejor los escenarios clínicos. Como cada órgano y su microambiente es único y no se pueden replicar mediante una implantación subcutánea, es importante usar el modelo ortotópico siempre que esté disponible.
At preclinical oncology, we offer several luciferase-enabled models for this purpose.
Contáctenos si desea conversar más sobre este modelo.
Referencias
1. Erstad DJ, et al., 2018. Orthotopic and heterotopic murine models of pancreatic cancer and their different responses to FOLFIRINOX chemotherapy. Dis Model Mech., Jul 1; 11(7): dmm034793
2. Devaud C, et al., 2014. Tissues in different anatomical sites can sculpt and vary the tumor microenvironment to affect responses to therapy. Mol Ther., Jan 22(1):18-27
3. Guerin MV, Finisguerra V, Van den Eynde BJ, Bercovici N and Trautmann A, 2020. Preclinical murine tumor models: a structural and functional perspective. eLife., 2020;9:e50740
4. Qui W and Su GH. 2013. Development of orthotopic pancreatic tumor mouse models. Methods Mol Biol., 980:215-223
5. Kurahara H, et al., 2011. Significance of M2-polarized tumor-associated macrophage in pancreatic cancer. J Surg Res., May 15; 167(2):e211-e219
6. Parente P, et al., 2018. Crosstalk between the tumor microenvironment and immune system in pancreatic ductal adenocarcinoma: Potential targets for new therapeutic approaches. Gastroenterology Res and Practice. 2018:7530619
7. Lankadasari M, et al., 2019. TAMing pancreatic cancer: combat with a double-edged sword. Mol Cancer 18:48
Conéctese
Conversemos
Contáctenos