Autor: Sumithra Urs, PhD | Científica, Desarrollo Científico
Date: June 2019
Pancreatic cancer is the ninth most commonly diagnosed cancer and ranks as one of the deadliest with the lowest 5-year survival rate of 5-8%.[1,2,3] This year alone, the American Cancer Society estimates that 56.770 people will be diagnosed with the disease of which more than 45.750 people may not survive. Pancreatic ductal adenocarcinoma (PDAC) being the most prevalent and aggressive form of exocrine pancreatic cancer accounts for ~90% of cases with mortality equaling incidence.[4,5]
Al momento del diagnóstico, una gran mayoría de pacientes con ADP tienen la enfermedad localmente avanzada, no extirpable o metastásica. La propagación silenciosa de la enfermedad, y la aparición de síntomas específicos solo en estadios avanzados, hace que la detección a tiempo sea muy difícil y contribuye a las bajas tasas de supervivencia. Las opciones de tratamiento para pacientes elegibles para una extirpación incluyen cirugía seguida por quimioterapia sistémica de primera línea (gemcitabina, FOLFIRINOX, paclitaxel) o quimiorradioterapia combinada. For locally advanced, unresectable patients, the regimen includes multi-agent chemotherapy (5-FU, oxaliplatin, irinotecan) or chemoradiotherapy.[6] As these treatments have offered limited benefits to pancreatic cancer patients, newer options like immunotherapy drugs are now being tested in clinical trials.
El ADP está caracterizado por la presencia de estroma fibroso, baja carga mutacional, falta de infiltración de células T CD8+ y la presencia de poblaciones de células mieloides inmunosupresoras, y todo esto contribuye a las características no inmunogénicas típicas del tumor.[7] Los enfoques actuales para mejorar la respuesta a tratamiento se centran en aumentar el tráfico de células T a los tumores usando agentes como radioterapia (RT). La RT sola, en la mayoría de los tumores sólidos, tiene el potencial de activar el sistema inmunológico para desencadenar una respuesta antitumoral tras las muerte citotóxica y liberación de señales inmunoestimulantes. Sin embargo, en pacientes con ADP, el resultado de RT de dosis alta sola, o en combinación con agentes de quimioterapia, sigue siendo en general insatisfactoria[8] y los ensayos clínicos con agentes de inmunoterapia con un solo agente indican tasas de respuesta precarias de tan solo 1-2%.[9] En este momento al menos 21 ensayos clínicos en curso están investigando la combinación de RT con otros agentes inmunoestimulantes, lo que puede ser un camino prometedor para el tratamiento de ADP y amerita seguir investigando.[10] En la misma línea, en la plataforma preclínica estamos evaluando terapias individuales y combinadas usando el modelo de ADP murino Pan02. El Pan02 es un modelo de adenocarcinoma Grado III consolidado desarrollado por inducción química con 3-MCA (3-metilcolantreno) en ratones C57BL/6 macho.[11] En este artículo destacado sobre el modelo presentamos datos in vivo sobre la cinética de crecimiento del modelo tumoral Pan02, su respuesta a anticuerpos inmunomoduladores, radiación focalizada y la combinación de RT con agentes inmunomoduladores probados en la variedad de ratón C57BL/6 singeneico.
Parámetros de crecimiento del modelo Pan02
El implante subcutáneo del modelo Pan02 resulta en un buen prendimiento de los tumores con un tiempo de duplicación promedio de 4 a 5 días. Tras el implante, los ratones permanecen en estudio por ~30 días (imagen 1) sin pérdida de peso (datos no mostrados). La cinética de crecimiento permite usar una ventana terapéutica de más de tres semanas para evaluar respuestas antitumorales en este modelo.

El análisis de inmunotipificación de tumores Pan02 por citometría de flujo confirmó la baja infiltración de células linfoides en los tumores (imagen 2). While CD8+ and CD4+ helper T cells constituted only 1,6% and 1% of the CD45+ population, respectively, the immunosuppressive myeloid cell populations were present in abundance. Las CSDM-M y MAT M1 y M2 fueron las subpoblaciones celulares dominantes. Este perfil inmune tumoral es característico de un modelo tumoral no inmunogénico o "frío", similar al que se observa en pacientes con ADP.

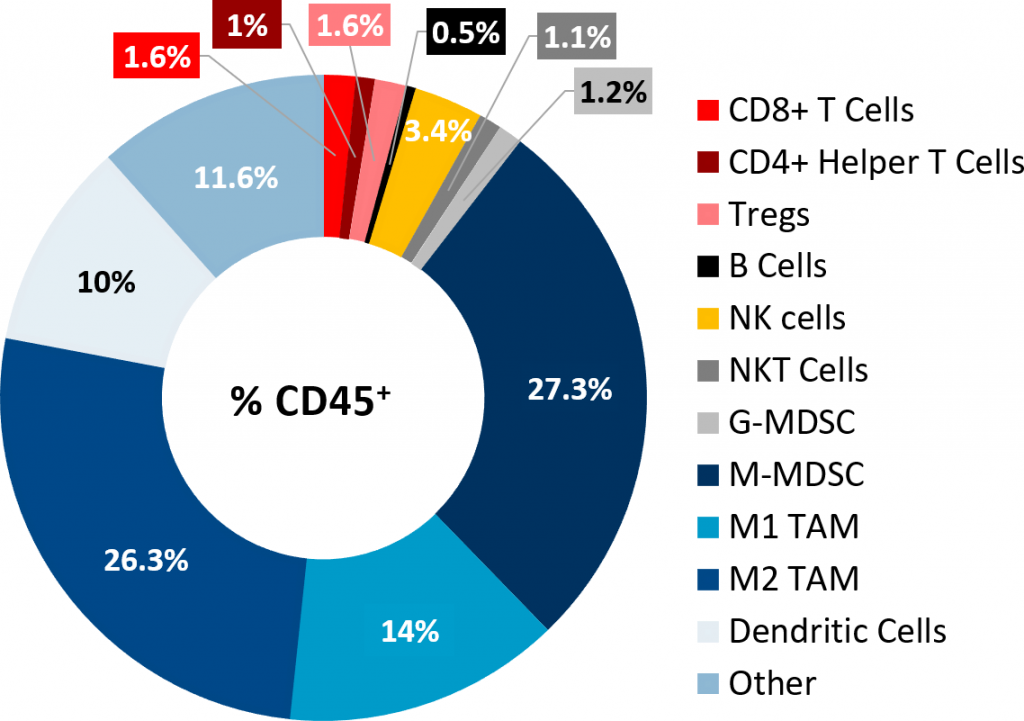
Imagen 2: Perfil inmune tumoral de tumores Pan02 subcutáneos.
Respuesta del modelo Pan02 a tratamientos con un solo agente
El tratamiento con un solo agente de ratones con tumores Pan02 con gemcitabina (100 mg/kg, Q3Dx4), una de las quimioterapias más comúnmente utilizadas en pacientes con cáncer de páncreas, se toleró muy bien y produjo un retraso en el crecimiento tumoral (TGD) estadísticamente significativo (imagen 3).

Imagen 3: Respuesta del modelo Pan02 a gemcitabina.
Dada la investigación de inmunoterapias en ADP clínicamente, nos propusimos evaluar la respuesta de nuestro modelo Pan02 a una variedad de anticuerpos inmunomoduladores (imagen 4). Sin embargo, en concordancia con el perfil inmunosupresor de los tumores Pan02, no fue ninguna sorpresa que este modelo tuvo una respuesta mínima/nula a los inhibidores de puntos de control anti-mPD-1, anti-mPD-L1 y anti-mCTLA-4, y a los anticuerpos coestimuladores anti-mCD137 y anti-mOX40. Todos los anticuerpos se administraron dos veces por semana a 10 mg/kg en un total de 4 dosis (imagen 4).

Imagen 4: Respuesta del modelo Pan02 a anticuerpos inmunomoduladores.
Respuesta del modelo Pan02 a la radiación y tratamientos combinados
Los pacientes con ADP suelen recibir radioterapia. En nuestro modelo murino empleamos la Small Animal Radiation Research Platform (SARRP; Xstrahl) para administrar una sola dosis de radiación focalizada (5 Gy o 10 Gy) directamente al tumor y observamos un retraso en el crecimiento tumoral dependiente de la dosis de 9,5 y 22 días respectivamente, en comparación con los ratones de control sin tratar (imagen 5).
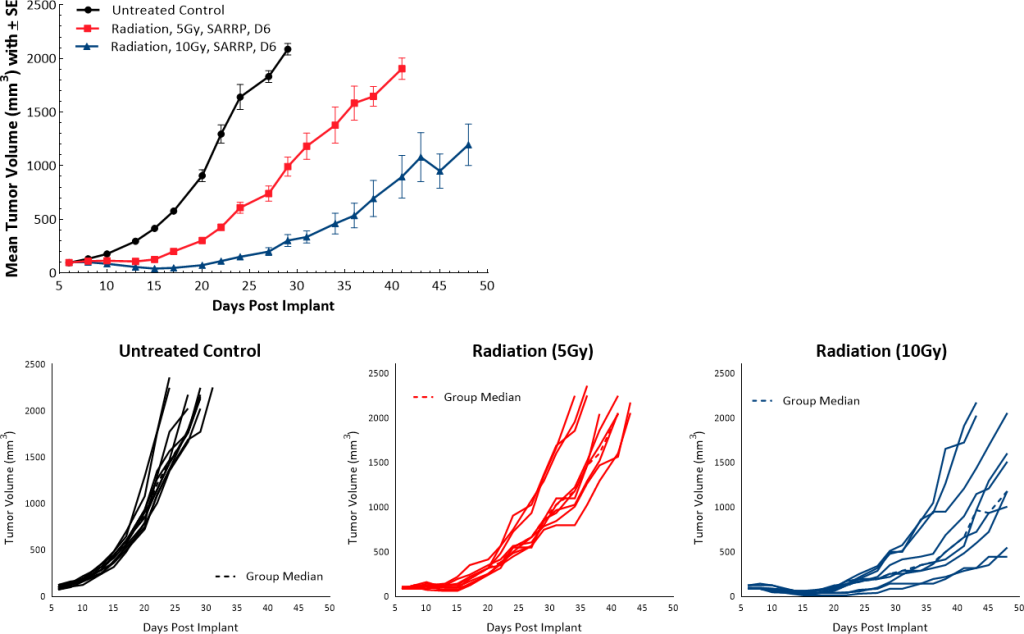
Imagen 5: Respuesta del modelo Pan02 a radiación focalizada.
Para investigar los efectos antitumorales de la RT en combinación con inhibidores de puntos de control, se usó una sola dosis de 5 Gy junto con anticuerpos anti-mPD-1 o anti-mPD-L1. En los grupos de control de isotipo y sin tratar se observaron tasas de crecimiento superpuestas y el tratamiento con inhibidores de puntos de control con un solo agente anti-mPD-1 y anti-mPD-L1 no generó ninguna respuesta antitumoral. Mientras que una sola dosis de RT de 5 Gy tuvo un TGD de 9,5 días en comparación con el grupo de control sin tratar, la combinación con inhibidores de puntos de control no contribuyó significativamente a mejorar la respuesta antitumoral. El tratamiento de RT con anti-mPD-1 o con anti-PD-L1 tuvo un TGD de 13 y 11,2 días respectivamente (imagen 6).
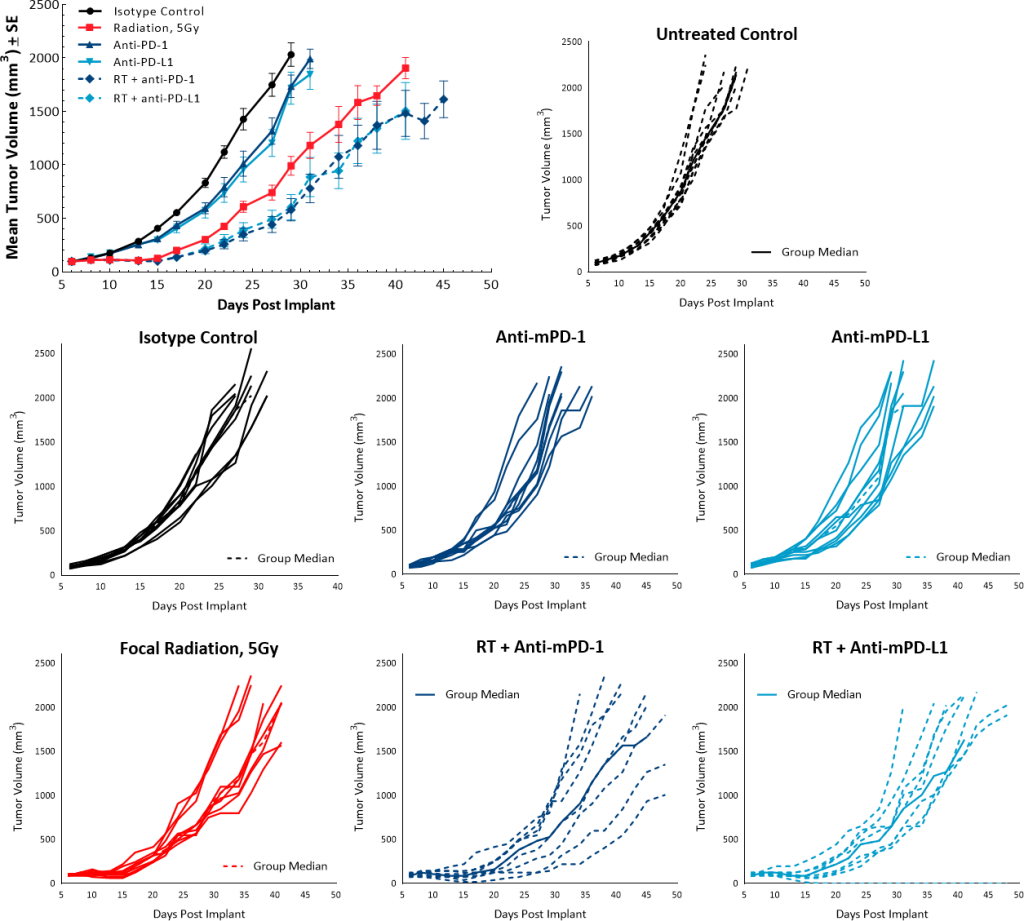
Imagen 6: Respuesta del modelo Pan02 a combinación de radiación e inhibidores de puntos de control.
Futuros trabajos con el modelo Pan02
Se están haciendo estudios para evaluar el potencial de usar varias combinaciones para mejorar la respuesta al tratamiento en el modelo Pan02 subcutáneo. Además, hace poco generamos una línea celular Pan02 activada por luciferasa para poder hacer estudios en el entorno ortotópico.
Referencias
2"SEER Cancer Stat Facts". National Cancer Institute, NIH. (https://www.cancer.gov).
3Pancreatic Cancer Action Network (https://www.pancan.org/).
4Gunderson AJ, Yamazaki T, McCarty K et al. "Blockade of fibroblast activation protein in combination with radiation treatment in murine models of pancreatic adenocarcinoma". Plos One 2019, 14(2): e0211117.
5Kabacaoglu D, Ciecielski KJ, Ruess DA y Algul H. "Immune checkpoint inhibition for pancreatic ductal adenocarcinoma: current limitations and future options". Frontiers in Immunology 2018, 9:1876.
6Saung MT y Zheng L. "Current standards of chemotherapy for Pancreatic cancer". Clin. Ther. 2017,39(11):2125-2134.
7Azad A, Lim SY, D'Costa Z et al. "PD-L1 blockade enhances response of pancreatic ductal adenocarcinoma to radiotherapy". EMBO, Molecular Medicine 2017, 9(2):167-180.
8Lauffer DC, Kuhn PA, Kueng M et al. "Pancreatic cancer: Feasibility and outcome after radio-chemotherapy with high dose radiotherapy for non-resected and R1 resected patients". 2018. Cureus 10(5): e2713.
9Javle M, Golan T y Maitra A. "Changing the course of pancreatic cancer - focus on recent translational advances". Cancer Treatment Reviews. 2016; 44:17-25.
10Gajiwala S, Torgeson A, Garrido-Laguna I, Kinsey C y Lloyd S. "Combination immunotherapy and radiation therapy strategies for pancreatic cancer - Targeting multiple steps in the cancer immunity cycle". J Gastro Oncol, 2018; 9(6):1014-1026.
Conéctese
Conversemos
Contáctenos