Date: March 2018
Como explicamos en el artículo destacado sobre modelo del mes pasado, el cáncer de pulmón es una enfermedad devastadora y es la causa principal de muerte por cáncer en los EE. UU. y el mundo.1 La comunidad de investigación sigue buscando nuevos modelos que ayuden a investigar el cáncer de pulmón. La ATCC (un repositorio celular ampliamente utilizado) en este momento tiene más de 100 diferentes líneas celulares de cáncer de pulmón derivadas de humanos.
Como el cáncer de pulmón es tan prevalente, hay numerosas oportunidades para adquirir y caracterizar nuevas líneas humanas. Los científicos son cada vez más hábiles en distinguir las mutaciones que generan una mayor proliferación de aquellas que suprimen el crecimiento tumoral. Esta información es clave para desarrollar nuevas terapias para tratar el cáncer de pulmón.
Labcorp continues to investigate new and/or unconventional cell lines and understand their importance to our client's research. En este artículo destacado sobre modelo analizaremos algunas de estas líneas y cómo podemos aplicar nuestra especialización como un valioso recurso para nuestros clientes que buscan desarrollar los tratamientos del futuro.
NCI-H3122
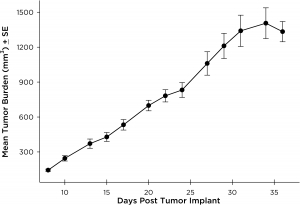
El modelo NCI-H3122 se derivó en 1981 de un carcinoma broncoalveolar primario del pulmón de un hombre de 52 años de edad antes de su tratamiento. Esta línea celular alberga la proteína de fusión EML4-ALK (gen 4 semejante a la proteína asociada a microtúbulos equinodermos fusionado con el gen de quinasa de linfoma anaplástico) y recientemente se ha identificado en un ~7% de pacientes con CPCNP (cáncer de pulmón de células no pequeñas) japoneses y un ~4,5% de todos los casos de CPCNP. El gen ALK es una diana de interés dada su capacidad de ser oncogénico. Como el modelo NCI-H3122 contiene EML4-ALK y es muy sensible a inhibidores de ALK de un solo agente parece que su supervivencia está mediada por una vía más adicta a ALK.2 Como modelo preclínico esta línea celular sería apta para probar nuevos inhibidores de ALK que no dependan de EGFR u otras vías involucradas en CPCNP. The model has been developed as a subcutaneous (SC) implant; however, we have also implanted this line intracranially to mimic the clinical setting where advanced NSCLC metastasizes to the brain. El crecimiento tumoral subcutáneo es confiable con una mínima variabilidad de un animal a otro. El tiempo de duplicación de volumen del tumor en el entorno SC es de ~7 días y los ratones generalmente alcanzan un tamaño de evaluación de ~750 mm3 en unos 25 días. Los datos iniciales con el modelo NCI-H3122 implantado intracranealmente son alentadores; en un estudio piloto hemos visto una tasa de prendimiento del 100% y un tiempo de duplicación de volumen tumoral, basado en una evaluación volumétrica, de ~7 días, que es consistente con la tasa de crecimiento SC (ver figuras 1 y 2). Como con muchos modelos intracraneales, la morbilidad (pérdida de peso corporal y observación clínica general) se usa para definir la supervivencia general. Para esta línea celular, el día promedio de muerte es a los ~35 días (ver figuras 2, 3 y 4).
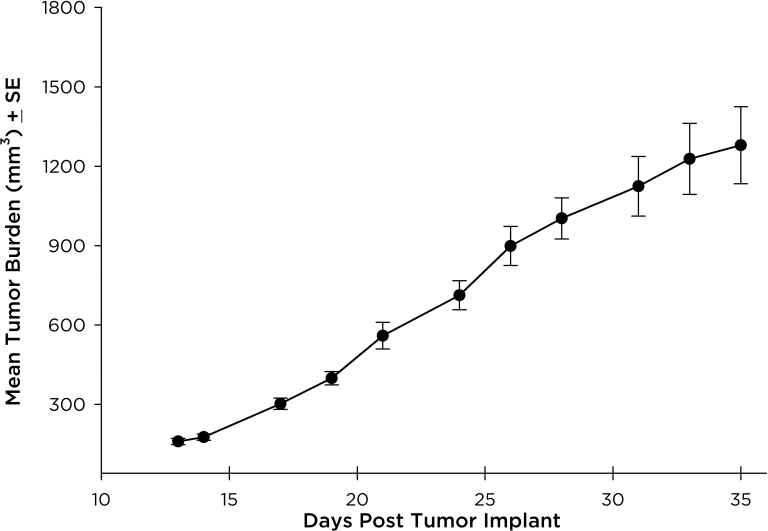
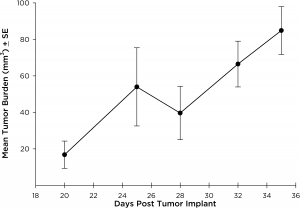
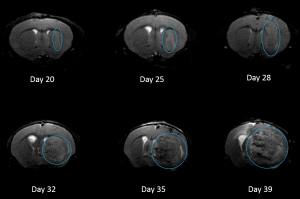
Fig. 1: carga tumoral media del NCI-H3122 subcutáneo
Fig. 2: crecimiento tumoral promedio de NCI-H3122 intracraneal por IRM
Fig. 3: % de cambio en peso corporal tras implante intracraneal de NCI-H3122
Fig. 4: H3122-3160 Representative Image
NCI-H1703
El modelo NCI-H1703 se derivó de un carcinoma de células escamosas de pulmón estadio 1 de un hombre caucásico fumador de 54 años de edad. Esta línea celular es de interés para la comunidad de investigación por los altos niveles de amplificación del receptor del factor de crecimiento derivado de plaquetas α (PDGFRα). NCI-H1703 is one of very few NSCLC models that have this expression profile and are sensitive to sunitinib in vitro. Clínicamente, los pacientes con cáncer de pulmón que expresan PDGFRα están asociados a una biología tumoral más agresiva y un peor pronóstico.3 Por lo tanto, este modelo es apto para evaluar nuevas dianas angiogénicas como VEGF y nuevas dianas PDGFRα independientemente de las vías de proliferación en superficie celular. The model is most commonly utilized following subcutaneous (SC) implant, however, we have also transfected this line with luciferase to allow for bioluminescence imaging to monitor disease progression following direct implant into the lung. Tumor growth is reliable following either SC or orthotopic (OT) lung implant. En ambos sitios de implante la variabilidad entre animales es mínima, el volumen tumoral se duplica cada 6 días (SC) y 11 días (OT). While the tumor growth rates are different for each implant site the mice typically reach evaluation size (~750mm3 or 1E+09 p/s) in approximately 30 days post implant (See Figures 5 [SC], 6, 7, and 8 [OT]).
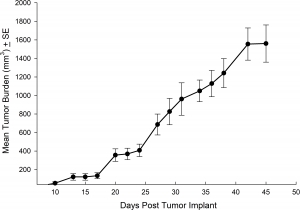
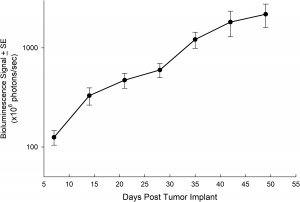
Fig. 5: carga tumoral media del NCI-1703 subcutáneo
Fig. 6: carga tumoral media del NCI-1703 implantado ortotópicamente.
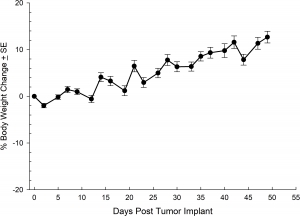
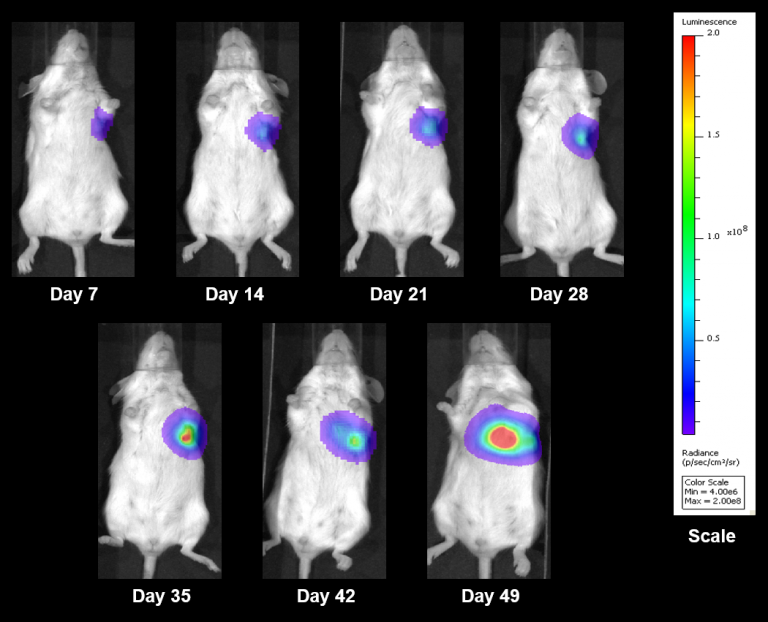
Fig. 7: % de cambio en peso corporal tras implante ortotópico de NCI-1703
Fig. 8: imágenes de BLI representantivas de implante ortotópico de NCI-1703
PC-9
El modelo PC-9 se aisló de un paciente hombre con adenocarcinoma pulmonar en 1989. Se ha reportado que el PC-9 es muy sensible al gefitinib y otros inhibidores de la tirosina quinasa EGFR. Sin embargo, se ha demostrado que una exposición prolongada de las células PC-9 a inhibidores EGFR puede dar como resultado la adquisición de la mutación T790M y una línea celular resistente. Este modelo sería útil al evaluar la nueva generación de inhibidores EGFR o posiblemente en la creación de una versión resistente para evaluar métodos de tratamiento alternativos. We have developed PC-9 as a subcutaneous model that demonstrates reliable growth with minimal animal-to-animal variability. El tiempo de duplicación de volumen tumoral es de ~7 días y los tumores normalmente alcanzan el tamaño de evaluación (~750 mm3) en aproximadamente 28 días tras el implante (ver imágenes 9).
Please contact us if you are interested in discussing any of our human NSCLC models.
Investigate our full list of human xenograft models, including our extensive NSCLC Bank.
Fig. 9: carga tumoral media del PC-9 subcutáneo
Referencias
2EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer. Jussi P. Koivunen, Craig Mermel, Kreshnik Zejnullahu, Carly Murphy, Eugene Lifshits,6 Alison J. Holmes, Hwan Geun Choi, Jhingook Kim, Derek Chiang, Roman Thomas, Jinseon Lee,9,10 William G. Richards, David J. Sugarbaker, Christopher Ducko, Neal Lindeman, J. Paul Marcoux, Jeffrey A. Engelman, Nathanael S. Gray, Charles Lee, Matthew Meyerson, and Pasi A. Jänne. Clin Cancer Res. 2008 Jul 1; 14(13): 4275–4283.
3Stromal Platelet-Derived Growth Factor Receptor α (PDGFRα) Provides a Therapeutic Target Independent of Tumor Cell PDGFRα Expression in Lung Cancer Xenografts. David E. Gerber, Puja Gupta, Michael T. Dellinger, Jason E. Toombs, Michael Peyton, Inga Duignan, Jennifer Malaby, Timothy Bailey, Colleen Burns, Rolf A. Brekken and Nick Loizos Molecular Cancer Therapeutics 10,12/1535-7163.MCT-12-0431 Published November 2012.
Conéctese
Conversemos
Contáctenos