Date: February 2020
Por naturaleza, los ratones inmunodeficientes carecen de inmunidad adquirida, lo cual los convierte en un huésped ideal para el trasplante y el crecimiento de células tumorales humanas. Los modelos de xenoinjertos preclínicos que utilizan ratones inmunodeficientes son limitados para la investigación de inmunoterapias debido a esta falta de células inmunitarias funcionales. Este artículo destacado hace hincapié en un método a través del cual los linfocitos T humanos se pueden propagar dentro de un ratón inmunocomprometido y promover el crecimiento de xenoinjertos de material tumoral.
Los ratones NOD-scid IL2Rγnull (NSG) con injertos de células mononucleares de sangre periférica humana (hPBMC) se han utilizado con éxito en modelos de xenoinjertos para evaluar la eficacia y la farmacodinámica de los inhibidores de puntos de control inmunológico dirigidos a epítopos de linfocitos T humanos1. Este modelo es único en comparación con los xenoinjertos convencionales, ya que las células T humanas funcionales pueden dirigirse a los epítopos humanos de un tumor dentro de un ratón con un alcance clínico directamente trasladable. Los ratones NSG presentan una deficiencia de poblaciones de células dendríticas y macrófagas y tienen dos mutaciones específicas que producen una alta deficiencia de linfocitos: la mutación Pkrdc inhabilita aspectos de la reparación de ADN que genera deficiencia de células B y células T en el ratón y la eliminación de IL2Rγ bloquea la maduración de células NK2. Esta combinación de deficiencias permite el prendimiento de injertos de hPBMC y la expansión de linfocitos T humanos en el ratón NSG.
El ratón NSG con injerto de hPBMC tiene limitaciones que se deben evaluar antes de la selección del donante humano y el modelo tumoral. En primer lugar, la administración de células inmunitarias generan una toxicidad mediada por células T que coincide con la enfermedad de injerto contra huésped (EICH), en la cual los linfocitos humanos atacan los tejidos de ratón y limitan la ventana terapéutica3. En segundo lugar, se ha observado que la eficiencia de los injertos, los tipos de células presentes y la actividad varían según los donantes humanos4. Finalmente, hemos observado casos de rechazo de las hPBMC del xenoinjerto de material tumoral humano (no se muestran datos). La evaluación de estos parámetros con el donante y el modelo tumoral elegido, antes de iniciar los estudios de eficacia definitivos, es fundamental para el éxito de los programas de desarrollo traslacional precoz.
Diseño experimental
El objetivo de este estudio es evaluar el prendimiento del injerto de linfocitos T humanos de las hPBMC administradas a ratones NSG con xenoinjertos subcutáneos de material tumoral humano. Para el cuidado y uso de animales en instalaciones con acreditación de AAALAC, se siguieron las pautas de la Guía para el cuidado y uso de animales de laboratorio. Se administraron hPBMC de cuatro donantes sanos diferentes (Hemacare, Los Ángeles, CA, EE. UU.) por vía intravenosa en ratones NSG (Jackson Laboratories, Bar Harbor, Maine, EE. UU., variedad n.º 0005557) con adenocarcinomas ductales pancreáticos MiaPaCa-2 humanos subcutáneos. Se analizaron el crecimiento tumoral, el peso corporal y las características similares a la EICH. Se recolectó sangre entera para el análisis por citometría de flujo de marcadores de linfocitos humanos para confirmar el prendimiento del injerto de donante de células CD45+, que incluyen células CD4+ y CD8+, en los días 14, 28 y 42 luego de la administración de hPBMC (figura 1).
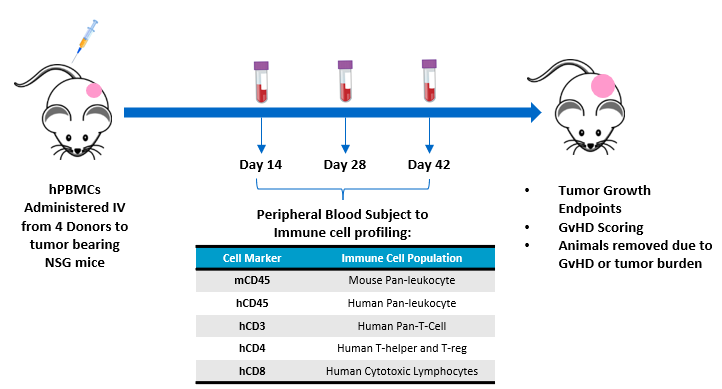
Figura 1 - Diseño experimental para evaluar el prendimiento de injertos de hPBMC en ratones NSG con tumores MiaPaca-2.
Crecimiento tumoral, peso corporal y evolución de la enfermedad
El tiempo de duplicación (Td) de los tumores MiaPaCa-2 en animales de control sin tratar fue de 9,1 días; el Td en animales a los cuales se administraron hPBMC fue de 8,7 a 11,6 días en cada grupo de donantes. Se observó una variabilidad de crecimiento en sujetos a los que se administraron hPBMC después de los 30 días posteriores al implante. El crecimiento tumoral antes de los 1000 mm3 no se vio afectado por el injerto de hPBMC (figura 2). Estos resultados sugieren que todos los donantes utilizados serían aptos para estudios de eficacia de MiaPaCa2 con un tiempo hasta el tamaño de evaluación (TES) de 1000 mm3.
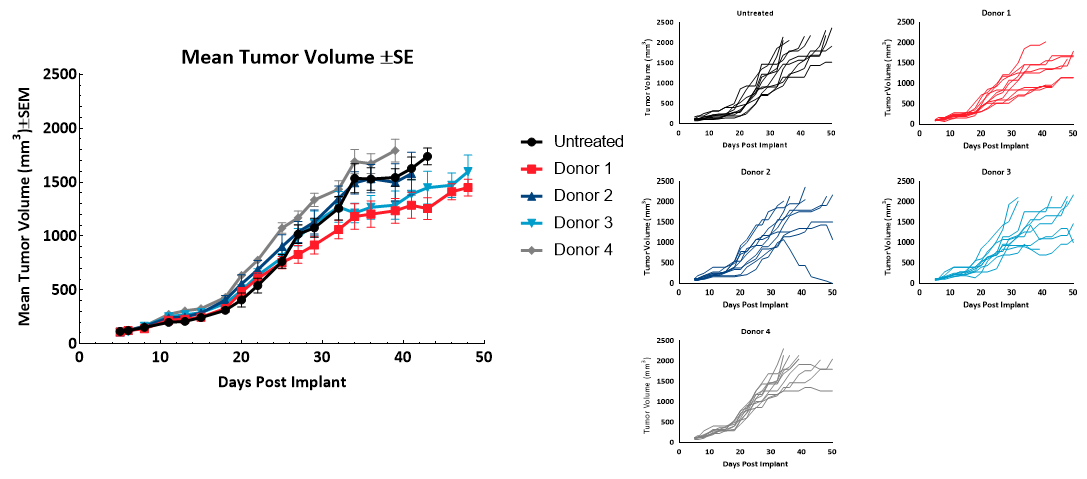
Figura 2 - Crecimiento de tumores MiaPaCa2 subcutáneos (n=10) luego de la administración de hPBMC.
Se monitoreó el comienzo de los síntomas de EICH mediante observaciones clínicas y de peso corporal; aunque no se confirmó desde el punto de vista patológico en este estudio, los síntomas observados en este modelo están fuertemente correlacionados con la enfermedad5. Los síntomas incluyen pérdida de peso corporal (figura 3) de más del 10% del peso inicial, pelaje áspero, postura encorvada, lesiones cutáneas y diarrea. Se eliminaron del estudio a aquellos animales que presentaron todos los síntomas o varios síntomas con un grado alto de intensidad. Treinta y dos días después de la inyección de hPBMC, se observaron los signos clínicos en la mitad de los animales o más de cada grupo. Los animales que no se eliminaron por síntomas de EICH se eliminaron debido a cargas tumorales de más de 2000 mm3 o al finalizar el estudio.
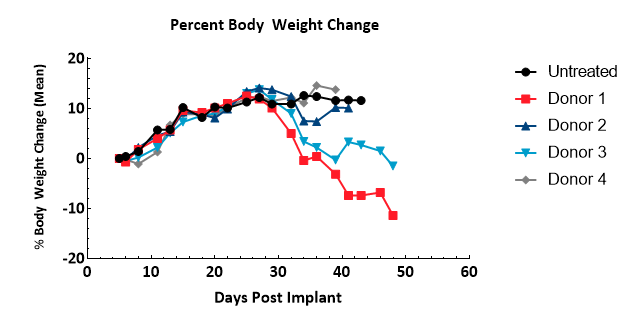
Figura 3 - Evaluación de cambios en el peso corporal tras la administración de hPBMC
Injerto y persistencia de linfocitos humanos
Se midió el prendimiento de injertos 14, 28 y 42 días después de la administración de hPBMC mediante el análisis inmunofenotípico de marcadores de células inmunitarias humanas en sangre periférica de ratones NSG: se detectaron mCD45 (pan-leucocitos murinos), hCD45 (pan-leucocitos humanos), hCD3 (células pan-T), hCD4 (células T colaboradoras y células T reguladoras) y hCD8 (linfocitos citotóxicos) mediante citometría de flujo (figura 4).
Se monitoreó el comienzo de los síntomas de EICH mediante observaciones clínicas y de peso corporal; aunque no se confirmó desde el punto de vista patológico en este estudio, los síntomas observados en este modelo están fuertemente correlacionados con la enfermedad5. Los síntomas incluyen pérdida de peso corporal (figura 3) de más del 10% del peso inicial, pelaje áspero, postura encorvada, lesiones cutáneas y diarrea. Se eliminaron del estudio a aquellos animales que presentaron todos los síntomas o varios síntomas con un grado alto de intensidad. Treinta y dos días después de la inyección de hPBMC, se observaron los signos clínicos en la mitad de los animales o más de cada grupo. Los animales que no se eliminaron por síntomas de EICH se eliminaron debido a cargas tumorales de más de 2000 mm3 o al finalizar el estudio.
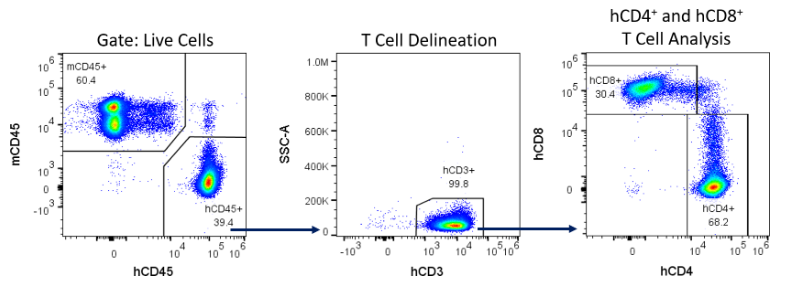
Figura 4 - Ejemplo de estrategia de gating para la detección de células inmunitarias humanas en ratones NSG reconstituidos con hPBMC.
El porcentaje de hCD45+ se calcula como el porcentaje de células hCD45+ del total de células vivas (en base a recuentos celulares absolutos/µL de sangre entera) y se usa como indicador del alcance del injerto de hPBMC. Descubrimos que se detectó un % de células hCD45+ en sangre entera a lo largo del tiempo en todos los donantes (figura 5). Sin embargo, los donantes 2 y 4 presentaron un mayor aumento de células hCD45 individualmente en comparación con los donantes 1 y 3 cuyo prendimiento del injerto no fue tan elevado al día 42 luego de la administración de hPBMC. Animals across all groups achieved %hCD45 engraftment levels 28 days post hPBMC administration that is consistent with published literature on the model6.
La administración de hPBMC en ratones NSG genera persistencia de células T humanas en el ratón con efectos mínimos en el crecimiento del tumor MiaPaCa-2. Este modelo representa una plataforma preclínica potente para analizar los efectos de agentes novedosos que utilizan linfocitos T humanos para controlar la actividad antitumoral con una importancia clínica directa. Los trabajos futuros demostrarán la eficacia de las inmunoterapias aprobadas por la FDA frente a los xenoinjertos de material tumoral humano en ratones NSG reconstituidos con hPBMC.
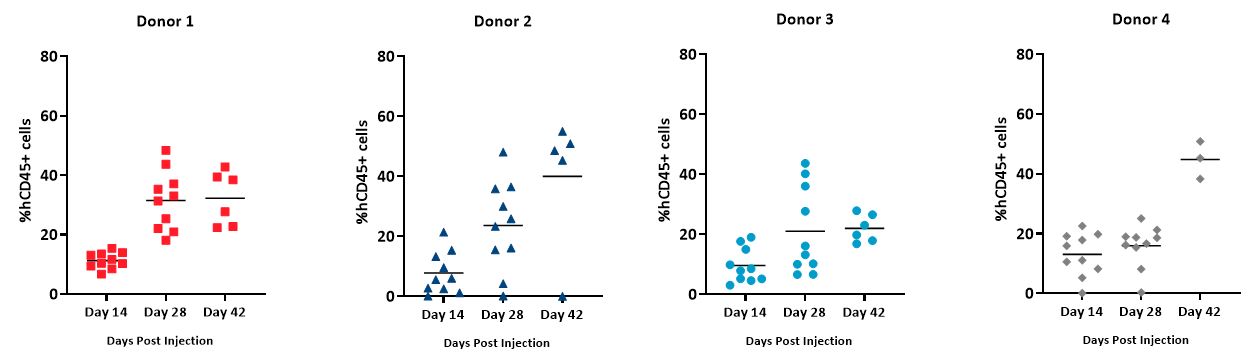
Figura 5 - Alcance del injerto de células hCD45+ detectadas en sangre entera de ratones NSG con administración de hPBMC
Please contact our preclinical oncology scientists to see how hPBMC engrafted NSG mice can be used for your next translational immuno-oncology study.
Referencias
Conéctese
Conversemos
Contáctenos