Date: May 2017
Se estima que en el año 2017 habrá aproximadamente 30.000 diagnósticos nuevos y alrededor de 13.000 pacientes fallecidos por mieloma múltiple. Sin embargo, es un tipo de cáncer relativamente raro con un riesgo de vida de 1 en 143 (0,7%). El riesgo de padecer mieloma múltiple aumenta con la edad y a la mayoría de las personas se les diagnostica la enfermedad a partir de los 65 años. Los hombres tienen probabilidades ligeramente mayores de desarrollar mieloma múltiple que las mujeres y los afroamericanos tienen el doble de probabilidades de presentar este tipo de cáncer. Sin embargo, el factor de riesgo más importante del mieloma múltiple es tener una enfermedad preexistente de células plasmáticas. Los pacientes que padecen gammapatía monoclonal de significado incierto (GMSI) o plasmacitoma solitario a la larga desarrollan mieloma múltiple.
El mieloma múltiple es una neoplasia de las células B clonales caracterizada por la acumulación de células plasmáticas terminalmente diferenciadas que producen anticuerpos en la médula ósea. Las mutaciones genéticas dentro de las células del mieloma y su interacción con diversas citocinas y factores de crecimiento contribuyen a la capacidad invasiva de la enfermedad y una resistencia superior a los fármacos. Los pacientes suelen no presentar síntomas hasta los últimos estadios de la enfermedad. Una vez que se detecta la enfermedad, es común que se localice en los huesos, especialmente la columna vertebral. Actualmente, la terapia por excelencia es una combinación de doxorrubicina y dexametasona con bortezomib. La incorporación de bortezomib mejora la tasa de respuesta general en casi un 50%.1
Una línea celular que se usa comúnmente para evaluar terapias novedosas para el mieloma múltiple es la MM.1S. La línea MM.1S proviene de una mujer afroamericana de 42 años de edad y se ha documentado que expresa CD25, CD38, CD52 y CD59. It also expresses the glucocorticoid receptor and is dexamethasone sensitive.2 In an effort to more effectively monitor in vivo disease progression, we transfected the MM.1S line with luciferase (MM.1S-pMMP-LucNeo). Mediante la imagenología por bioluminiscencia (BLI), podemos monitorizar la evolución de la enfermedad diseminada a lo largo del tiempo y hallar crecimiento in vivo reproducible en ratones (figuras 1 y 2).
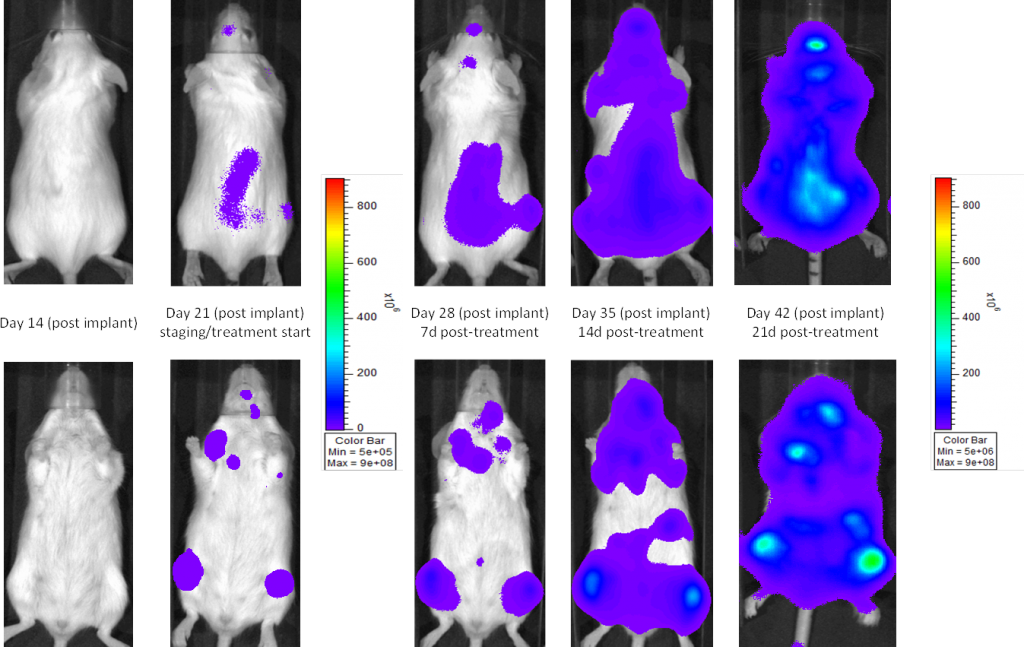
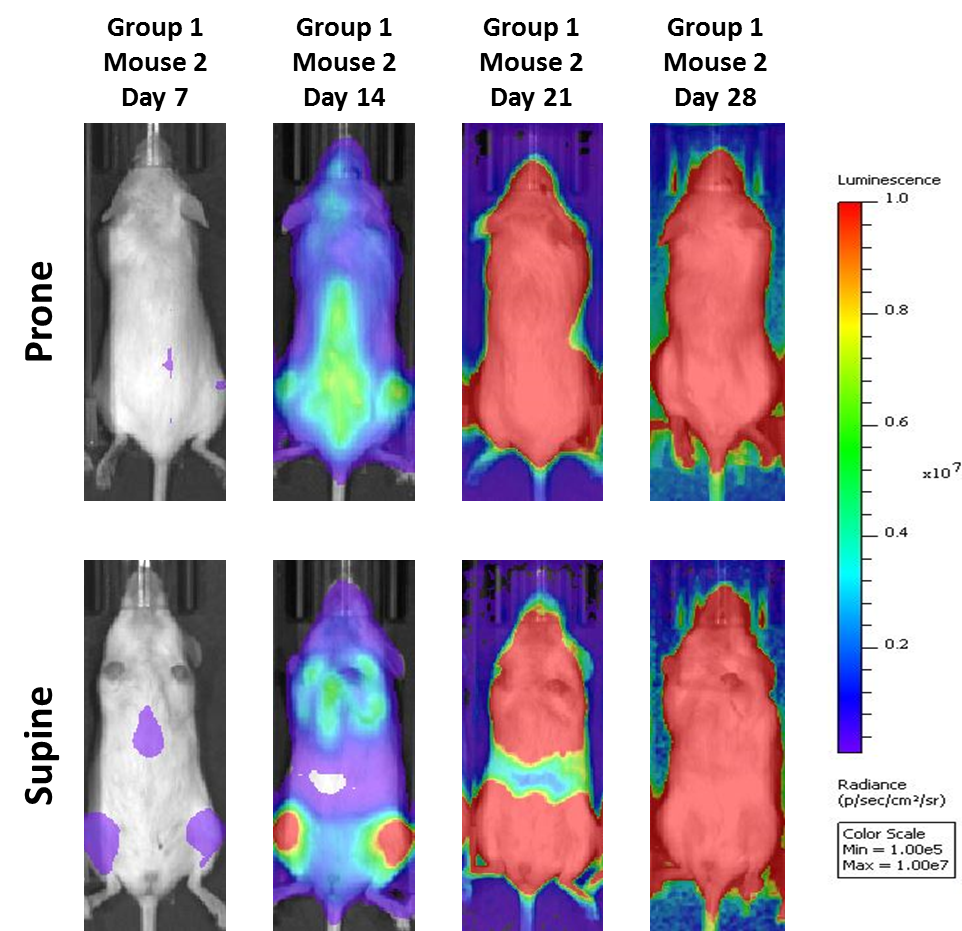
Fig. 2: mieloma múltiple humano MM.1S-pMMP-LucNeo en ratones NSG: imágenes representativas de la evolución de la enfermedad - Control de medio
Señal de BLI de la carga tumoral promedio
En ratones SCID beige, el promedio de tiempo de duplicación de volumen del tumor es de ~2 días (figura 3) y el promedio de tiempo hasta el criterio de valoración de morbilidad/mortalidad es de 35 a 45 días. Para optimizar el modelo MM.1S-pMMP-LucNeo, caracterizamos el crecimiento en la variedad de ratones NSG que muestra una aparición más agresiva de la enfermedad (con una presentación a los siete días del implante en comparación con los 15 días que tarda en ratones SCID). En ratones NSG, el tiempo de duplicación de volumen del tumor es de ~1,8 días (figura 4) y el promedio de tiempo hasta el criterio de valoración es de ~21 días, aproximadamente la mitad del tiempo de sobrevida total que se observó en los ratones SCID beige.
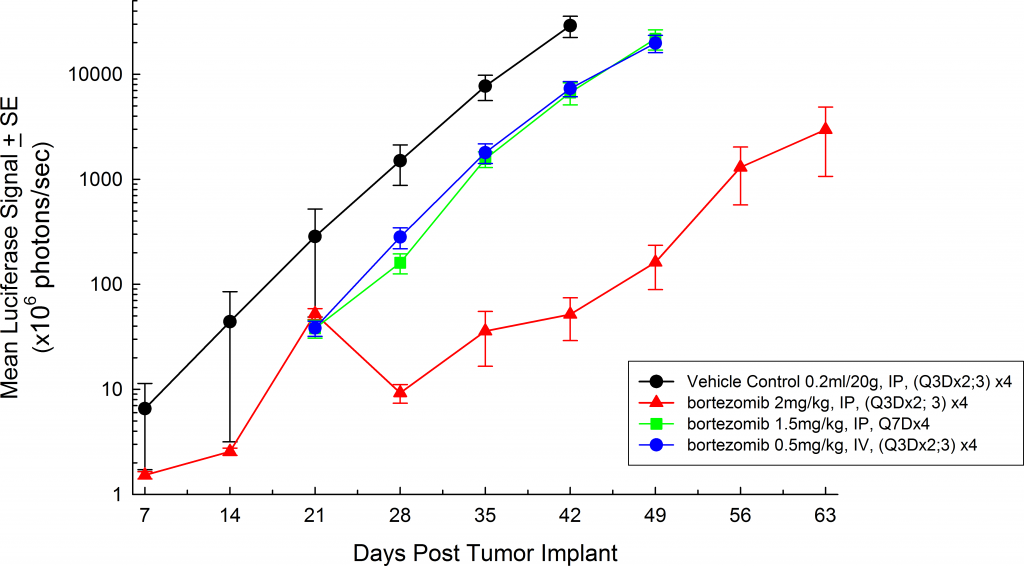
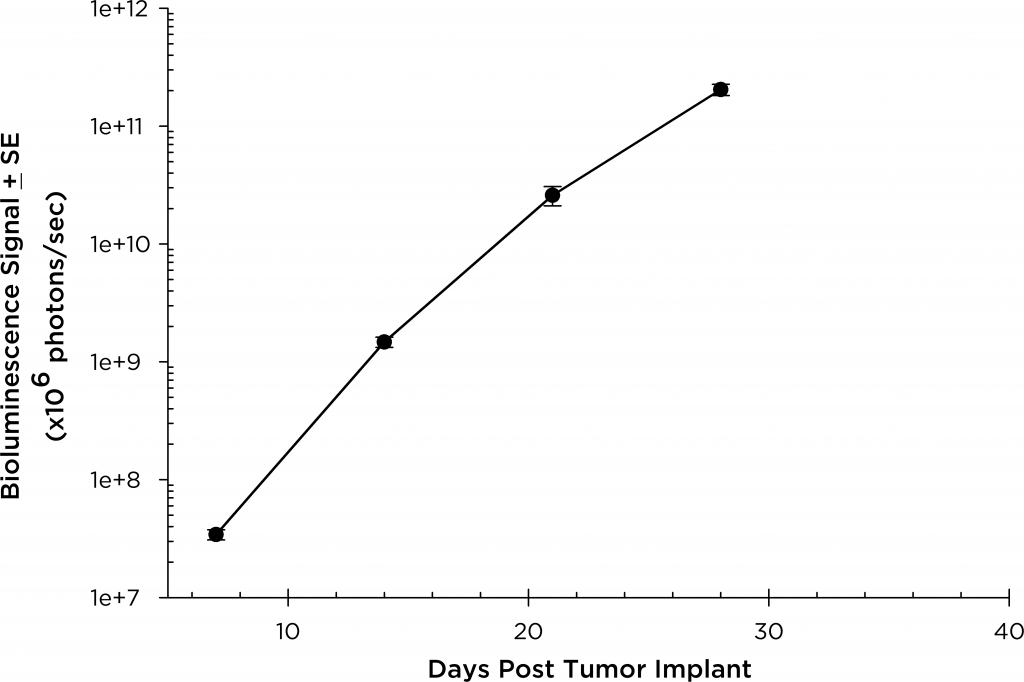
Fig. 3: mieloma múltiple humano MM.1S-pMMP-LucNeo en ratones SCID beige: señal de BLI de la carga tumoral promedio
Fig. 4: mieloma múltiple humano MM.1S-pMMP-LucNeo en ratones NSG: señal de BLI de la carga tumoral promedio
Porcentaje promedio de cambio en el peso corporal
En todas las variedad de ratones que investigamos, los animales se mostraron relativamente asintomáticos durante todo el estudio y únicamente comenzaron a presentar síntomas en las fases tardías de la enfermedad (figuras 5 y 6), similar a cómo se manifiesta la enfermedad en humanos. Algunos signos clínicos de fases tardías en ratones son el letargo y la parálisis. La BLI en estos animales muestra una localización de la señal en la columna vertebral, los huesos largos y la mandíbula. El bortezomib de un solo agente (Velcade®) tiene un efecto limitado en la evolución de la enfermedad de este modelo. Esto es similar a los datos que se observan en la clínica, los cuales sugieren que se puede mejorar la respuesta al tratamiento cuando se administra bortezomib en combinación con otros agentes. El modelo MM.1S, que incluye la capacidad de reproducción junto con aspectos traslacionales de la evolución y la respuesta de la enfermedad, ofrece una plataforma para evaluar tratamientos novedosos de un solo agente y combinaciones farmacológicas.
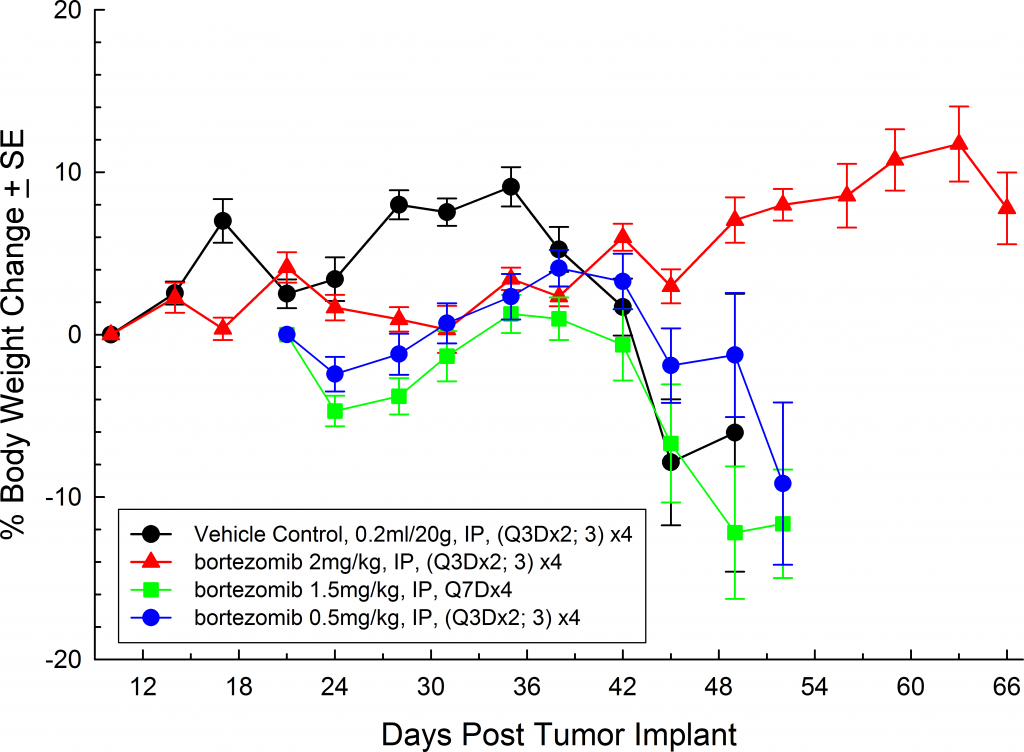
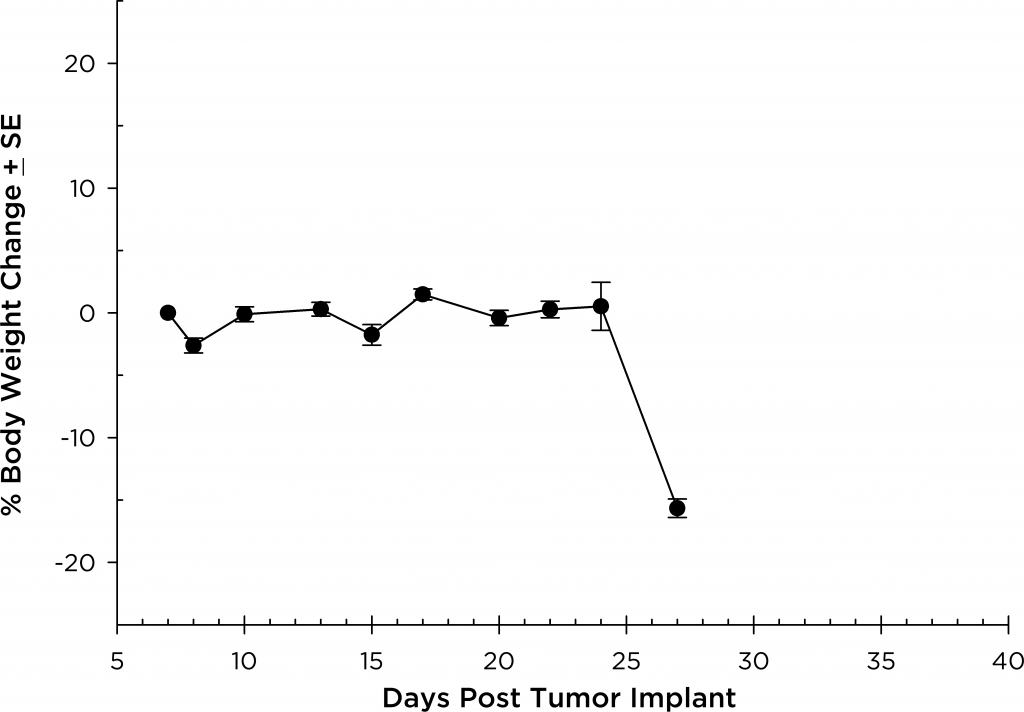
Fig. 5: MM.1S-pMMP-LucNeo human multiple myeloma in SCID Beige mice: Mean % Body Weight ChangeFig. 6: MM.1S-pMMP-LucNeo human multiple myeloma in NSG mice: Mean % Body Weight Change
Referencias
Conéctese
Conversemos
Contáctenos