Autor: Sumithra Urs, PhD | Científica, Desarrollo Científico
Date: October 2018
Hepatocellular carcinoma (HCC) is an aggressive malignancy which has gradually increased in incidence to affect one million people worldwide and is currently the third leading cause of cancer related deaths in the world.[1,2] The prevalence of HCC is highest in Asia and Africa due to high endemicity of hepatitis B and C viruses which strongly predispose to the development of chronic liver disease and subsequent HCC.[1]
In the Western population, hepatitis C, alcoholic cirrhosis, and non-alcoholic steatohepatitis (NASH) are the main underlying causes. Mientras que algunas opciones de tratamiento para el CHC de fase temprana son la extirpación quirúrgica, el trasplante de hígado, la quimioembolización o radioembolización y la ablación por radiofrecuencia, la norma de cuidado para el CHC avanzado es el uso de terapias dirigidas (sorafenib y regorafenib), radioterapia y quimioterapia (doxorrubicina, 5-FU y cisplatino).[3] Hay muchos ensayos clínicos en curso para el CHC no extirpable o de etapa avanzada con monoinmunoterapia o inmunoterapia combinada, anticuerpos monoclonales o terapias con virus oncolíticos.[1-4] Estas terapias han demostrado una reducción de los tumores y una mejor supervivencia pero no son curativas y los resultados de los tratamientos dependen de condiciones preexistentes como hepatitis, cirrosis hepática o enfermedad del hígado graso no alcohólica (EHGNA). Por lo tanto, hay una necesidad cada vez mayor de mejores opciones de tratamiento. To evaluate novel therapies in a preclinical platform, Labcorp has established the syngeneic HCC model Hepa 1-6.
Hepa 1-6 es un hepatoma murino derivado del hepatoma BW7756 que apareció espontáneamente en ratones C57L/J, el cual contrasta con la mayoría de los modelos de hepatoma disponibles (BNL, A.7R.1, MH-129, MH134 y MH-22A) que son líneas inducidas o transformadas químicamente. El modelo tumoral Hepa 1-6 establecido en ratones inmunocompetentes representa un modelo importante desde el punto de vista clínico para pruebas preclínicas de inmunoterapia.
In this model spotlight we present in vivo data on Hepa 1-6 tumor model growth kinetics; along with response to checkpoint inhibitors alone or in combination with focal radiation. Probamos el modelo en su variedad parental C57L/J (con disponibilidad limitada en The Jackson Laboratories, Bar Harbor, ME) y la variedad histocompatible C57BL/6 que está disponible con mayor facilidad.
Parámetros de crecimiento de Hepa 1-6
La cinética de crecimiento posterior a un implante subcutáneo muestra que el modelo se establece con éxito en ambas variedades de ratón (fig. 1). Los tumores tienen un tiempo de duplicación promedio de ~5-6 días sin cambios adversos en el peso corporal (no se muestran datos). Esta tasa de crecimiento estable permite una ventana terapéutica de tres semanas para evaluar las respuestas antitumorales.
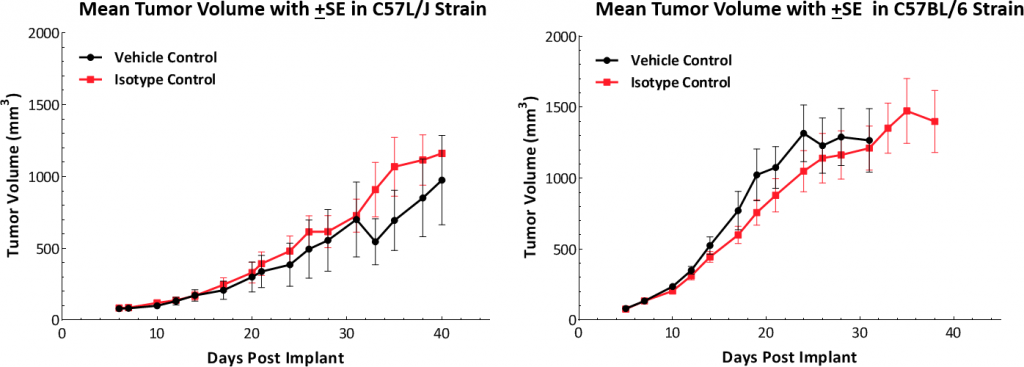
Fig. 1: cinética de crecimiento del tumor Hepa 1-6 en ratones C57L/J y C57BL/6.
Perfil inmune del tumor Hepa 1-6
Para comprender el perfil inmune de los tumores Hepa 1-6, se analizó la composición inmune inicial mediante citometría de flujo, que se muestra en la fig. 2. Se estableció el perfil inmune a partir de cinco tumores Hepa 1-6 sin tratar en la variedad C57L/J a un volumen de ~750-1000 mm3. Los tumores tienen una población de células CD45+ relativamente alta (un promedio del ~60%), de la cual los linfocitos T (células T CD8+ y células T CD4+ colaboradoras) tuvieron una representación moderada (un promedio del ~11% y ~6%, respectivamente). La población mieloide tuvo una representación predominante de G-MDSC (promedio del ~30%) seguidas de M-MDSC (promedio del ~11%). La infiltración de células T CD8+ en el microambiente del tumor sugiere que se trata de un modelo tumoral inmunológicamente receptivo o "tibio".
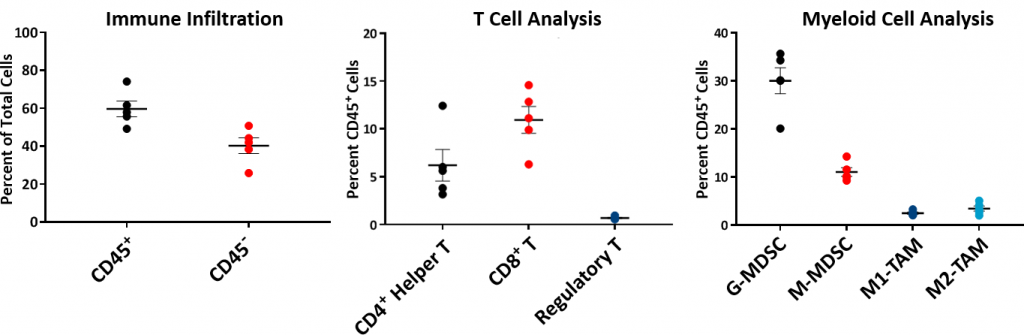
Fig. 2: perfil inmune inicial del tumor Hepa 1-6 en ratones C57L/J.
Respuesta de Hepa 1-6 a los inhibidores de puntos de control
Se evaluó la respuesta del tumor Hepa 1-6 a agentes inmunomoduladores en ratones C57BL/6 con tumores (volumen tumoral promedio de ~100 mm3) que recibieron un tratamiento con anticuerpos bloqueadores de puntos de control (anti-mPD-1, anti-mPD-L1 y anti-mCTLA-4). Los controles, el medio (PBS) y el isotipo (IgG2b de rata, clon LTF-2) mostraron una cinética de crecimiento comparable (fig. 1). Los inhibidores de puntos de control anti-mPD-1 y anti-mCTLA-4 de agente individual provocaron una fuerte respuesta que condujo a la regresión completa del tumor (CR) y un 100% de sobrevivientes libres de tumores (TFS). El tratamiento con anti-mPD-L1 también produjo una buena respuesta en un subconjunto de animales que generó como resultado la CR y 5/10 TFS (fig. 3). El tratamiento con anticuerpos inhibidores de puntos de control no se asoció a ningún cambio significativo en el peso corporal relacionado con animales de control (no se muestran datos). La respuesta a la inmunoterapia refuerza marcadamente la caracterización de los tumores Hepa 1-6 como "calientes" desde el punto de vista inmunológico.
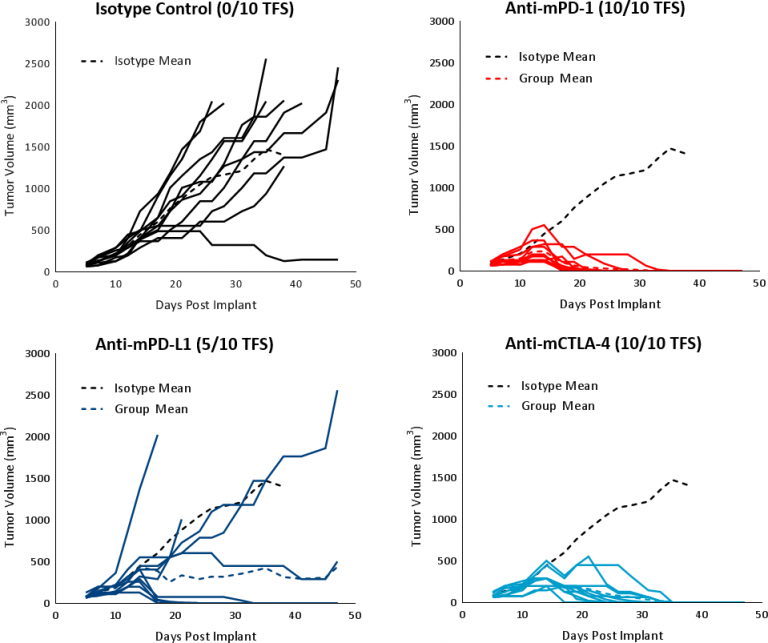
Fig. 3: respuesta del tumor Hepa 1-6 a los inhibidores de puntos de control en ratones C57BL/6.
Respuesta a la radiación focalizada
En términos clínicos, los pacientes con CHC sin metástasis reciben una o más terapias dirigidas al hígado (LDT) como radioterapia (RT) o radioterapia estereotáctica del cuerpo (SBRT).[5] La RT puede lograr la reducción del tumor y alterar el microambiente del tumor para convertirlo en un medio favorable para la supresión tumoral. Para poner a prueba la respuesta de los tumores Hepa 1-6 a la RT, usamos la Small Animal Radiation Research Platform (SARRP; Xstrahl) para producir una radiación focalizada en áreas específicas. Se probaron dosis de radiación focalizada de 5 y 10 Gy en tumores Hepa 1-6 subcutáneos en ratones C57BL/6. El tratamiento demostró una respuesta dependiente de la dosis y logró como resultado una demora en el crecimiento tumoral (TGD) de >20 días y sobrevivientes libres de tumores (2/10 y 8/10, respectivamente) (fig. 4). Una dosis de 5 Gy permitió una respuesta moderada a la monoterapia con una mayor expectativa de vida y se recomienda para estudios combinados futuros.
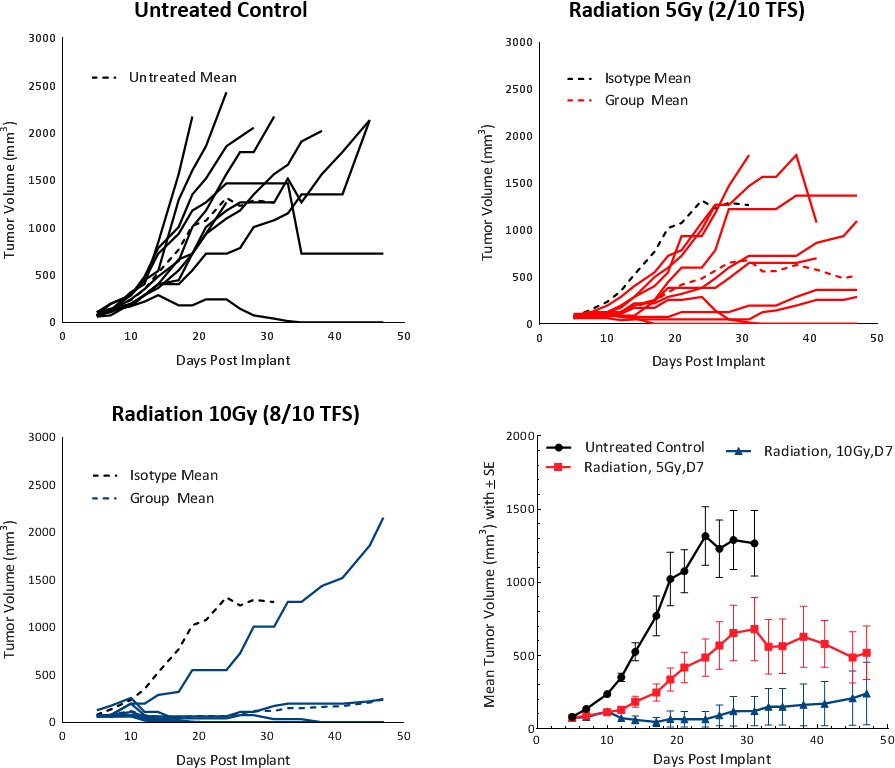
Fig. 4: respuesta del tumor Hepa 1-6 al tratamiento con radiación en ratones C57BL/6.
Respuesta de Hepa 1-6 al sorafenib
Se probó en tumores Hepa 1-6 el sorafenib, un inhibidor de multitirosina quinasa que bloquea la actividad de los receptores de quinasa Raf, Src, VEGF y PDGF y se utiliza como tratamiento de primer nivel en pacientes con CHC. El tratamiento generó como resultado una demora en el crecimiento tumoral de 25,4 días y extendió la supervivencia general pero no logró TFS (fig. 5). Estos resultados son comparables con los resultados de estudios clínicos donde se mostró una respuesta parcial con un aumento en el promedio de supervivencia general de 7,9 meses en el grupo de control a 10,7 meses en el grupo bajo tratamiento.[1]
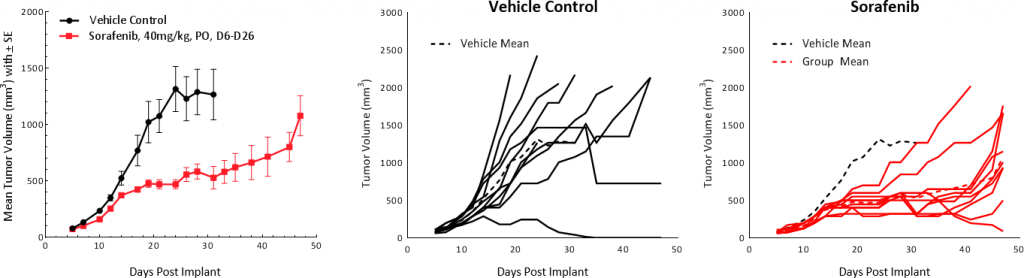
Fig. 5: respuesta del tumor Hepa 1-6 al tratamiento con sorafenib en ratones C57BL/6.
Estos datos preliminares sugieren que el modelo de CHC Hepa 1-6 tiene un perfil inmune favorable y se puede emplear como modelo preclínico sólido en inmuno-oncología. Nuestros datos respaldan el uso de este modelo en la investigación de agentes de inmunoterapia como monoterapia o en combinación con radiación, moléculas pequeñas, normas de cuidado y otros tratamientos terapéuticos novedosos.
Please contact us to speak with our scientists about how Hepa 1-6 can be used for your next immuno-oncology study.
Referencias
[1]Medavaram, S and Zhang Y, 2018. Emerging therapies in advanced hepatocellular carcinoma. Exp Hematol Oncol 7:17.
[2]Llovet JM, Montal R, Sia D and Finn RS, 2018. Molecular therapies and precision medicine for hepatocellular carcinoma. Nat Rev Clin Oncol. doi: 10,1/s41571-018-0073-4. [Epub ahead of print] PMID:30061739.
[3]Pinter M & Peck-Radosvljevic M. 2018. Review article: systemic treatment of hepatocellular carcinoma. 2018. Aliment Pharmacol Thera, 23 de julio. doi: 10,11/apt.14913. [Epub ahead of print] Review. PMID: 30039640.
[4]Waidmann O. 2018. Recent developments with immunotherapy for hepatocellular carcinoma. Expert Opin Biol Ther. Ago.; 18(8):905-910.
Conéctese
Conversemos
Contáctenos