Author: Mark J Cameron, Director of Scientific Development
Date: November 2020
Durante la investigación y el desarrollo preclínicos, a menudo se investigan las terapias de células T con CAR (receptores de antígenos quiméricos) con ratones como sujetos de prueba. En este entorno, los ratones inmunocomprometidos llevan una carga tumoral de origen humano y se les administran células CAR-T humanas alogénicas. Las células transferidas de forma adoptiva son dirigidas por el receptor de antígenos quiméricos manipulado para unirse a un antígeno de superficie de una célula tumoral (CD19, por ejemplo).
Como resultado de la unión de la célula T manipulada a la célula tumoral, la célula T se activa y destruye las células tumorales sin restricciones del CMH. Mice in preclinical research studies are followed for a number of predefined parameters, evaluating tumor growth and burden to determine the efficacy of the CAR T cells (Learn more about how efficacy can be determined by bioluminescence imaging (BLI).
Un factor de éxito fundamental de la respuesta antitumoral de las células CAR-T es el tiempo que viven las células CAR-T luego de su infusión en el huésped (persistencia). Despite full functionality, it has been shown that poor persistence of CAR T cells can limit an effective antitumor response.1 In the clinical setting, long-term remission in patients with hematological malignancies is associated with sustained persistence of CAR T cells.2 Co-stimulatory signaling is thought to influence T cell expansion and persistence. Preclinical studies investigating the efficacy of CAR constructs that are engineered to include the 4-1BB co-stimulator domain have been associated with long CAR T cell persistence, a slower and sustained effector function, and a higher proportion of memory T cells.3 Assessing CAR T persistence in preclinical studies have implications in determining clinical success.
Este artículo destacado sobre tecnología brindará información al lector sobre la medición de la persistencia de células CAR-T mediante citometría de flujo durante la fase preclínica.
Modelos de ratones para la evaluación de candidatos para células CAR-T
En septiembre de 2017, la Administración de Medicamentos y Alimentos aprobó la primera terapia con células CAR-T. La terapia celular es comercializada por Novartis y se llama Kymriah. Kymriah también se conoce como tisagenlecleucel y fue aprobada para niños y adultos jóvenes que ya no responden a terapias estándar para la leucemia linfoblástica aguda de células B. La terapia Kymriah está basada en el trabajo de Carl June, PhD en ratones NSGTM en la Universidad de Pensilvania.
El ratón NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, conocido generalmente por el nombre de la marca, NOD scid gamma (NSG™), no expresa el gen Prkdc ni el gen Il2rg ligado al cromosoma X. La mutación en la scid (inmunodeficiencia combinada severa) se encuentra en la proteína Prkdc del complejo de reparación del ADN y produce una deficiencia de células B y T en los ratones. Estos ratones no tienen células del sistema del complemento ni células exterminadoras naturales (NK) y presentan una deficiencia en las vías de señalización de citocinas. Debido a estas deficiencias, los ratones son ideales y altamente susceptibles al injerto de células inmunes humanas, incluidas las células CAR-T. Se injerta una amplia variedad de tumores humanos en los ratones y son el método por excelencia para la investigación preclínica de células CAR-T.
En nuestro departamento de Oncología Preclínica podemos usar cualquier variedad de ratones comercialmente disponibles para estudios de terapias con células CAR-T y otros estudios de transferencia adoptiva de células, incluso ratones NSGTM, y bajo ciertas condiciones podemos aceptar ratones especiales.
El panel PersistenceTTM del área de Oncología Preclínica se usa para generar datos longitudinales de persistencia de células CAR-T y se puede usar con tan solo 5 uL de sangre entera. Está diseñado como ensayo con protocolo de lisado/no lavado y recuentos absolutos. El panel tiene flexibilidad y ofrece la oportunidad de agregar sensores anti-CAR específicos en los canales FITC, PE y APC. A los ratones NSG de Jackson Laboratory (Bar Harbor, Maine, EE. UU.) se les administró 2x107 PBMC humanas, se les extrajo sangre 7, 14 y 21 días luego de la administración y se sometieron a la evaluación del panel PersistenceTTM.
La tabla 1 describe los reactivos que se utilizan en el panel PersistenceTTM. La estrategia de gating se detalla en la figura 1.
Anticuerpo/tinte |
Descripción |
|---|---|
mCD45 |
Células pan-hematopoyéticas de ratón |
hCD45 |
Células pan-hematopoyéticas humanas |
hCD3 |
Marcador de células pan-T humanas |
hCD4 |
Marcador de células T CD4+ humanas |
hCD8 |
Marcador de células T CD8+ humanas |
Microesferas de recuento |
Ofrece conteos absolutos |
Tinte de viabilidad |
Exclusión de células muertas |
Opcional: específico de CAR |
FITC, PE o APC |
Tabla 1: panel PersistenceTTM de anticuerpos y descripción de su uso.
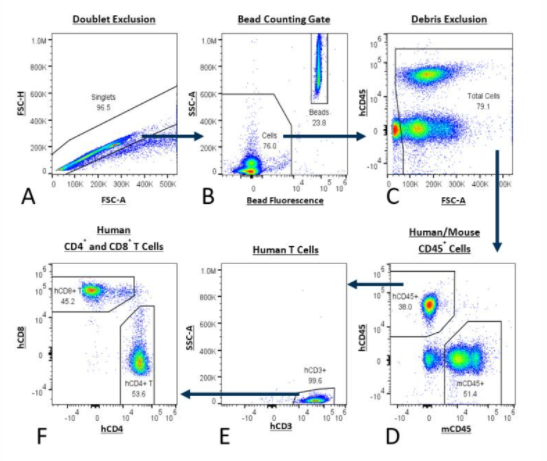
Figura 1: análisis de células T humanas mediante el uso del panel PersistenceTTM. La estrategia de gating comienza con la doble exclusión (A) y luego avanza a la combinación de fluorescencia de microesferas con un gate de recuento de microesferas (B). A continuación, se excluyen los restos (C) y se distinguen las células de ratón de las células humanas mediante el uso de anti-CD45 de ratón con anti-CD45 de humano (D). Se aíslan las células T humanas a través del gating con anti-CD3 de humanos (E) y, finalmente, se determina la cantidad de células T CD8+ y CD4+ humanas (F).
Caracterización inmunofenotípica longitudinal de células CAR-T mediante el uso del panel PersistenceTTM
En el entorno de oncología clínica, la expansión y persistencia de las células CAR-T se correlacionan con la respuesta y con conseguir la remisión en los pacientes.4 Debido a esta observación, establecer métodos confiables para rastrear las cantidades de células CAR-T tiene especial importancia, no solo para calcular la efectividad de la terapia con células CAR-T, sino también para evaluar la seguridad en el entorno preclínico. Serious side effects of clinical CAR T cell therapy are noted, one of the most severe being cytokine release syndrome (CRS) and is associated with CAR T cell expansion in vivo.5
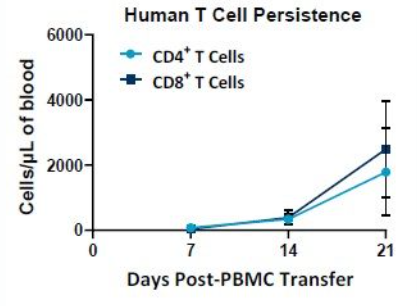
The PersistenceTTM Panel is directly applicable to the evaluation of human CAR T cell numbers in samples taken from mice over time. Debido a los bajos requisitos de sangre entera, es posible obtener muestras del mismo ratón varias veces o a través del uso de cohortes de ratones para lograr los objetivos de los estudios. Los ratones NSG se pueden usar para estudios de larga duración para evaluar la persistencia de células CAR-T de forma específica. La figura 2 muestra un ejemplo de cómo se puede usar el panel PersistenceTTM para medir las células T humanas en ratones NSG a lo largo del tiempo.
Mejorar la persistencia de células CAR-T
La persistencia de células CAR-T in vivo es un marcador secundario de la eficacia clínica a largo plazo de la terapia con células CAR-T. Los estudios han demostrado que ciertas células CAR-T que contienen un dominio coestimulador CD28 muestran una mayor expresión de genes relacionados con el agotamiento de células T, mientras que el dominio coestimulador 4-1BB (TNFSF9) con la misma especificidad antigénica redujo el fenotipo agotado. Esto puede ayudar a explicar por qué, en ensayos clínicos de pacientes con leucemia linfoblástica aguda recidivante o refractaria, se ha informado que las células CAR-T que expresan un dominio CD28 persisten hasta 3 meses, mientras que las células CAR-T con un dominio 4-1BB persisten hasta 5 años, y más de 6 meses en casi todos los casos que se pudieron evaluar.6
Células CAR-T a lo largo de las generaciones
Las células CAR-T siguen evolucionando mediante la modificación del receptor de antígenos quiméricos. Cada célula CAR-T tiene un scFv (fragmento Fv monocatenario variable). El scFv es una combinación de los dominios de la región variable de la cadena pesada (VH) y la región variable de la cadena ligera (VL). Un scFv es una proteína de fusión de la VH y VL de las inmunoglobulinas, conectada con un péptido de enlace corto de entre 10 y 25 aminoácidos.
Los CAR de primera generación tienen un dominio de unión extracelular, una región bisagra, un dominio transmembrana y uno o más dominios de señalización intracelular. Todas las células CAR-T tienen el dominio de cadena CD3 ζ para la señalización intracelular y es el principal transmisor de señales de activación de células T. La incorporación de un dominio coestimulador (CD28 o 4-1BB) definió los CAR de segunda generación. El objetivo era mejorar la proliferación de células T, la secreción de citocinas y la persistencia in vivo.
Los datos preclínicos muestran que los CAR de tercera generación tienen una mejor función efectora y una persistencia in vivo más prolongada en comparación con los CAR de segunda generación. Los CAR de tercera generación tienen varios dominios coestimuladores (CD28-41BB o CD28-OX40). Las células CAR-T de cuarta generación a veces se denominan CAR "armados" y TRUCK (siglas en inglés de "células CAR-T redirigidas para la exterminación universal de citocinas"). Las células CAR-T de cuarta generación pueden incluir factores que mejoran la expansión de células T, la actividad antitumoral y la persistencia.7
Independientemente de la generación CAR o TRUCK, el panel PersistenceTTM es una excelente herramienta para la monitorización a corto o largo plazo de la persistencia in vivo de células CAR-T en el entorno preclínico.
Resumen
Medir la persistencia de células CAR-T es sencillo con el panel PersistenceTTM. Nuestro panel de citometría de flujo permite determinar la persistencia longitudinal de células CAR-T a partir de un pequeño volumen de sangre. Nuestro panel Human CompTTM (tabla 2) es un excelente ejemplo de cómo se pueden agregar otros paneles calificados a un estudio preclínico de células CAR-T para la generación de conjuntos exhaustivos de datos de citometría de flujo.
Anticuerpo/tinte |
Descripción |
|---|---|
hCD45 |
Células pan-hematopoyéticas humanas |
hCD3 |
Marcador de células pan-T humanas |
hCD4 |
Marcador de células T CD4+ humanas |
hCD8 |
Marcador de células T CD8+ humanas |
hCD25 |
Marcador de células T reguladoras humanas |
hFoxP3 |
Marcador de células T reguladoras humanas |
hPD-1 |
Proteína de señalización de inhibidores de células T humanas |
hCD69 |
Marcador de activación |
Ki-67 |
Marcador de proliferación |
Tinte de viabilidad |
Exclusión de células muertas |
Tabla 2. Marcadores individuales del panel de leucocitos Human CompTTM.
To learn more about how the PersistenceTTM Panel, or one of our other flow cytometry panels, can be incorporated into your preclinical oncology research and to learn more about our extensive flow cytometry program contact the scientists.
Referencias
1Song DG, Ye Q, Carpenito C, Poussin M, Wang LP, Ji C, Figini M, June CH, Coukos G, Powell DJ Jr. In vivo persistence, tumor localization, and antitumor activity of CAR-engineered T cells is enhanced by costimulatory signaling through CD137 (4-1BB).
Cancer Res. Jul. de 2011 1;71(13):4617-27.
2Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. N Engl J Med. 2014;371(16):1507–17.
3Long AH, Haso WM, Shern JF, Wanhainen KM, Murgai M, Ingaramo M, et al. 4-1BB costimulation ameliorates T cell exhaustion induced by tonic signaling of chimeric antigen receptors. Nat Med. 2015;21:581–90.
4Porter DL, Hwang WT, Frey NV, Lacey SF, Shaw PA, Loren AW, et al. Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia. Sci Transl Med. 2015;7(303):303ra139.
5Santomasso B, Bachier C, Westin J, Rezvani K, Shpall EJ. The Other Side of CAR T-Cell Therapy: Cytokine Release Syndrome, Neurologic Toxicity, and Financial Burden.
Am Soc Clin Oncol Educ Book. Ene. de 2019; 39:433-444.
6Maus MV and June CH. Making Better Chimeric Antigen Receptors for Adoptive T-cell Therapy. Clin Cancer Res. Abril de 2016 15; 22(8): 1875-1884.
7Chmielewski M, Abken H. TRUCKs: the fourth generation of CARs. Expert Opin Biol Ther. 2015;15(8):1145-54.
Conéctese
Conversemos
Contáctenos