Date: December 2020
La aparición de terapias que aprovechan la actividad antitumoral intrínseca del sistema inmunológico contra el cáncer representa un cambio de paradigma en las terapias oncológicas que ha modificado para siempre el futuro de los tratamientos contra el cáncer.
El cáncer colorrectal (CCR) es uno de los tipos de cáncer más prevalentes y representa el 10% de todos los casos de cáncer; en 2018 se observaron más de un millón de nuevos casos de CCR en todo el mundo, con más de medio millón de muertes1. En cuanto al tratamiento clínico se suele recurrir a una extirpación quirúrgica seguida por quimioterapia adyuvante para cáncer de colon sin metástasis y terapias más focalizadas para CCR con metástasis2. Algunos estudios clínicos recientes demuestran sólidos resultados para la inhibición de puntos de control inmunitario en el tratamiento de pacientes con cáncer colorrectal metastásico no extirpable con alta inestabilidad microsatelital (IMS-A) o con deficiencia en la reparación de errores de emparejamiento (dMMR)3. El beneficio clínico fue tal que en el verano de 2020 se aprobó el fármaco Keytruda (un anticuerpo monoclonal que ataca la proteína de punto de control inmunitario PD-1 humana) como terapia de primera línea para pacientes con CCR que cumplen con estos tres criterios.4. Con esta nueva promesa de inmunoterapia contra el CCR, se necesitan modelos preclínicos altamente traslacionales de esta enfermedad para evaluar la eficacia de nuevos agentes de inmuno-oncología.
Para evaluar la eficacia de tratamientos focalizados en el sistema inmunológico se necesitan modelos tumorales preclínicos con sistemas inmunológicos intactos presentes para manipular los agentes de prueba. Los modelos tumorales singeneicos representan este tipo de estrategia, donde se cultivan células de cáncer derivadas de ratones para formar un tumor en la variedad de ratón inmunocompetente del origen de las células tumorales. We have extensively used CT26.WT murine colon carcinoma as a subcutaneous tumor model in female Balb/c mice to evaluate the efficacy of immuno-oncology agents - see our previous work in the model spotlights below (additional data available upon request):
- Destacado: carcinoma de colon murino CT26
- Póster: Caracterización de proliferación en diversos juegos secundarios de linfocitos en el modelo CT26 murino de carcinoma de colon a través de citometría de flujo multicolor
- Póster: Análisis de inmunofenotipos y transcriptomas de los modelos tumorales murinos CT26 y 4T1 luego del tratamiento con anti-CTLA-4
Reconocemos las limitaciones experimentales y traslacionales de los modelos tumorales subcutáneos: mantener un microambiente tumoral diferente comparado con los tumores que surgen del órgano de origen como, entre otros, perfiles de células inmunes dispares que pueden afectar la respuesta a la inmunoterapia5,6. La implantación de células tumorales en el tejido de origen, lo que se conoce como implante tumoral ortotópico, busca rectificar las limitaciones de los estudios subcutáneos y aumentar la posible capacidad traslacional del modelo.
En este artículo de modelo destacado presentamos datos que demuestran un modelo tumoral murino ortotópico usando un carcinoma de colon CT26.WT y métodos quirúrgicos confiables para la implantación y validando la respuesta a la inhibición de puntos de control.
Todo el trabajo en animales contó con la aprobación del Comité Institucional de Uso y Cuidado Animal del centro y se realizó conforme a la Guía para el cuidado y uso de animales de laboratorio dentro de un programa acreditado por la AAALAC con criterios de eutanasia humanitaria predeterminados en todos los estudios.
Crecimiento ortotópico de tumores CT26.WT-luc
Figura 1. Cinética de crecimiento de tumores derivados de CT26.WT-luc implantados ortotópicamente en ratones Balb/c
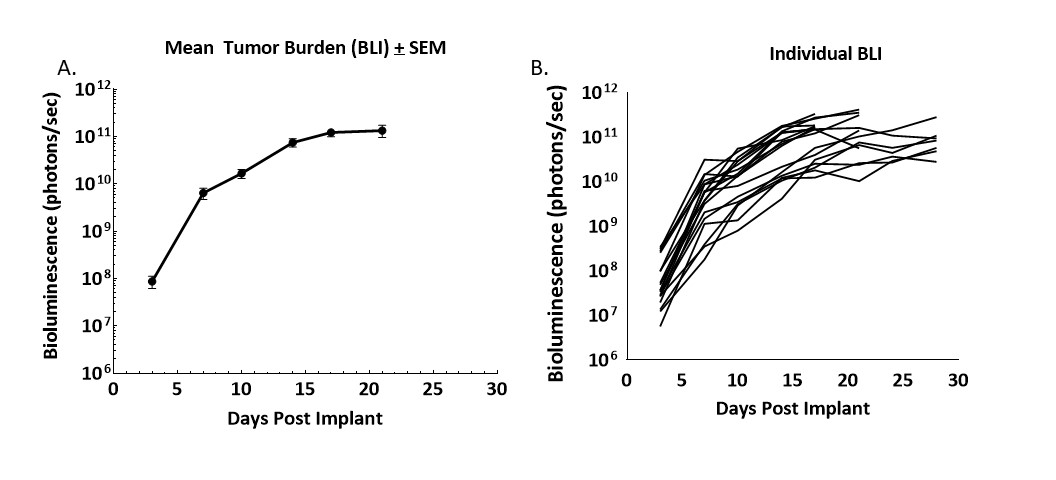
Figura 1 - Monitoreo longitudinal de la carga tumoral tras el implante ortotópico de fragmentos del tumor CT26.WT-luc mediante imagenología por bioluminiscencia de 20 ratones Balb/c. La bioluminiscencia se inició tres días después del implante; se presentan los valores promedio del grupo (A) e individuales (B).
La progresión de la carga tumoral fue robusta y mínimamente variable. El índice de prendimiento tumoral fue del 95% basado en la BLI y necropsia, y no se observaron regresiones espontáneas. El tiempo de duplicación (Td) de volumen del tumor derivado según la BLI fue de 1,5 días y el tiempo promedio en estudio fue de 21 días.
Las observaciones clínicas comunes asociadas a la evolución de la enfermedad fueron distensión abdominal por el crecimiento tumoral y aumento de peso corporal (los datos no se muestran). La necropsia reveló grandes masas primarias en el intestino ciego y pequeños nódulos en el hígado y pared abdominal. Los tumores primarios en el colon presentaron una gran integración vascular con el colon, lo que indica un reclutamiento vascular eficiente por parte del tumor. Nuestro siguiente enfoque fue usar este modelo para determinar la eficacia de agentes de inmuno-oncología.
Inhibición de puntos de control en el modelo tumoral CT26.WT-luc ortotópico
Se realizó un implante quirúrgico de fragmentos del tumor CT26.WT-luc en ratones Balb/c sin tratar tal como describimos anteriormente. Los animales se observaron por BLI tres días después de la cirugía y se distribuyeron en grupos de tratamiento según los valores de la BLI. Animals were treated by intraperitoneal administration of 10mg/kg isotype control (clone LTF-2), anti-mPD-L1 (clone 10F.9G2), anti-mCTLA-4 (clone 9D9) or anti-mPD-1 (clone RMP1-14) twice weekly for two weeks. Todos los anticuerpos se adquirieron de BioXCell (Lebanon, Nuevo Hampshire, EE. UU.). Se monitoreó a los animales dos veces por semana por BLI para medir la carga tumoral, tres veces por semana para registrar el peso corporal y se hicieron observaciones clínicas diarias y observaciones en la necropsia terminal.
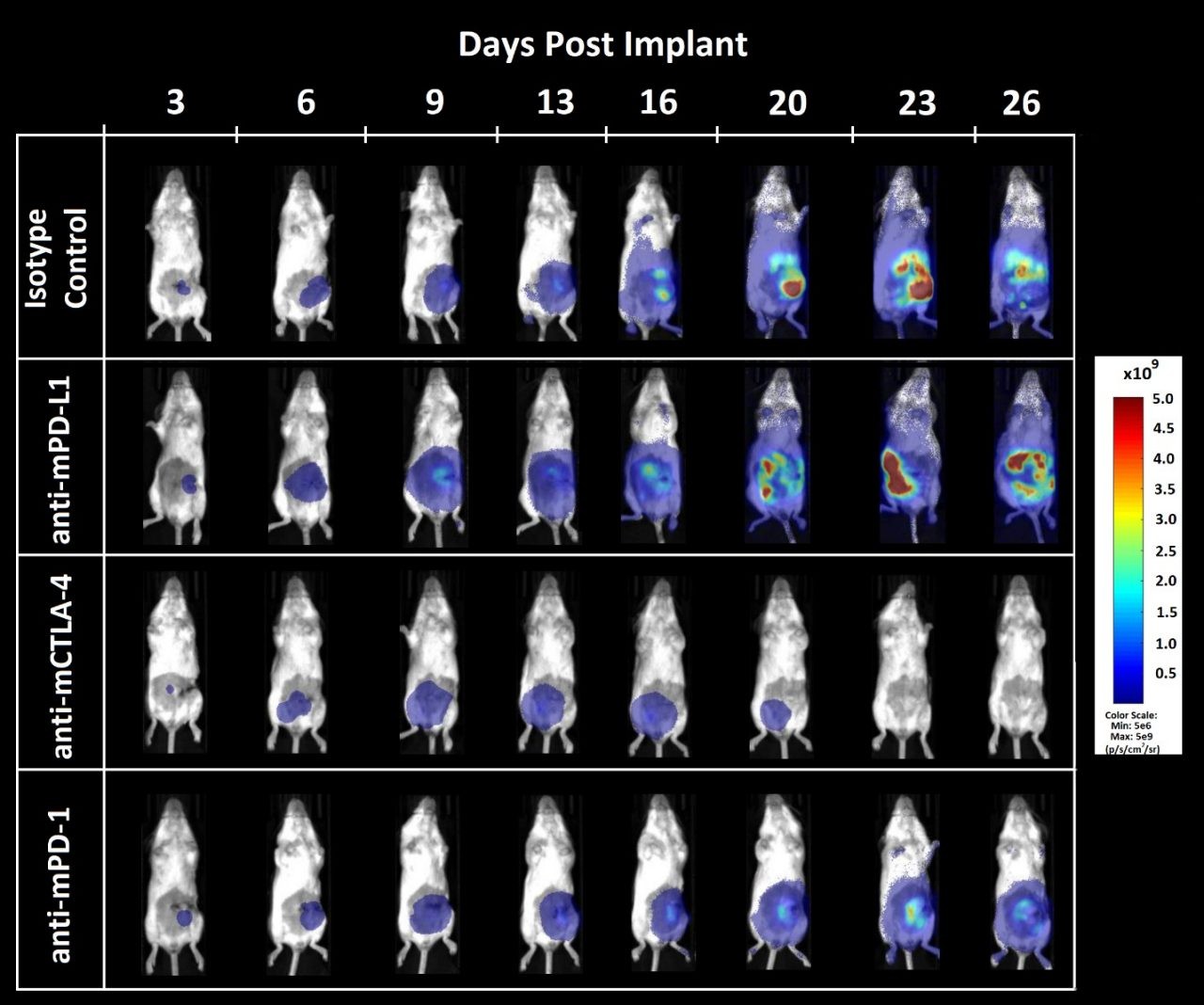
Figura 2 - Respuesta de tumores CT26.WT-luc implantados ortotópicamente a anticuerpos de bloqueo de puntos de control. Carga tumoral media grupal evaluada por BLI (A) y valores de BLI de animales individuales (B-E) en respuesta a terapias indicadas.
La administración del anticuerpo de control de isotopo no tuvo ningún efecto en la carga tumoral ni la evolución de la enfermedad (imagen 2A, 2B). El tiempo de duplicación tumoral en los animales a los que se administró el control de isotopo fue de 2,2 días, y el tiempo promedio en estudio fue de 28 días. El resultado de la administración de anti-mPD-L1 (imagen 2A, 2C) fue una regresión completa (carga tumoral no detectable por encima de los valores de BLI). El resultado del tratamiento con anti-mCTLA-4 (imagen 2A, 2D) fue de ΔT/ΔC del 0,1% en el día 23 y cinco regresiones parciales (valor de BLI menos la mitad del valor en el primer día de tratamiento) sin enfermedad visiblemente detectable en la necropsia. La administración de anti-mPD-1 (imagen 2A, 2E) no tuvo como resultado regresiones ni sobrevivientes sin tumores.
Imagen 3. Imagenología por bioluminiscencia de la respuesta del tumor ortotópico CT26.WT-luc a la inhibición de puntos de control
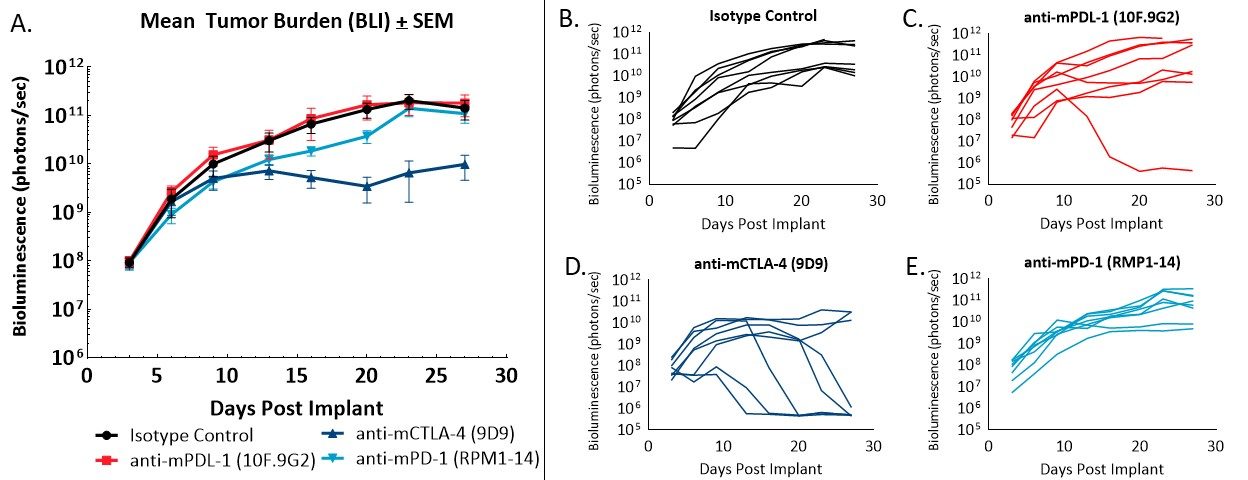
Figura 3 - Imagenología por bioluminiscencia de tumores derivados de CT26.WT-luc implantados ortotópicamente en ratones Balb/c hembra tratados con bloqueadores de puntos de control inmunitario. Los animales presentados representan el valor de BLI promedio para cada grupo respectivo.
La carga tumoral se localizó en el abdomen y aumentó con el correr del tiempo (imagen 3) tal como se esperaba basado en experimentos de crecimiento piloto anteriores (los datos no se muestran). El resultado del tratamiento con anti-mCTLA-4 fue un retraso en la aparición de aumento de peso relacionada con la enfermedad (los datos no se muestran). Con la administración de anti-mPD-L1 o anti-mCTLA-4 se observó un aumento en el beneficio de expectativa de vida sobre el control de isotopo de 12,5 y 23,6 días respectivamente. La necropsia terminal no reveló ninguna evidencia de tumores u otras lesiones en 1 de cada 8 animales tratados con anti-mPD-L1 y 5 de cada 8 animales tratados con anti-mCTLA-4.
Seguimos trabajando en la evaluación de las diferencias entre ubicaciones de implante CT26.WT subcutáneo y ortotópico con respecto a infiltrados de células inmunes a tumores, características histológicas y morfología, junto con la activación inmunológica en respuesta al bloqueo de puntos de control.
Tomando estos datos en conjunto, hemos demostrado que el modelo ortotópico CT26.WT-luc de cáncer de colon sirve como una plataforma robusta para evaluar agentes de inmuno-oncología en una ubicación de implante altamente traslacional.
Contact our scientists to learn more about the CT26.WT-luc, and other murine orthotopic tumor models, and how we can apply these tools to advance your oncology pipeline.
Referencias
1Bray F, et al. "Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries". CA Cancer J Clin 2018; 68:6, 394-424.
2Kuipers E, et al. "Colorectal Cancer". Nat Rev Dis Primers. 2015; 1: 15065.
3Tintelnot J, Stein A. "Immunotherapy in colorectal cancer: available clinical evidence, challenges and novel approaches". World J Gastroenterol. 2019; 25:29, 3920-3928.
4Administración de Medicamentos y Alimentos. "FDA approves first-line immunotherapy for patients with MSI-H/dMMR metastatic colorectal cancer". Comunicado de prensa, 29 de junio de 2020.
5Devaud C, et al. "Tissues in different anatomical sites can sculpt and vary the tumor microenvironment to affect responses to therapy". Mol Ther. 2014; 22:1, 18-27.
6Zhao X, Li L, Starr TK, Subramanian S. "Tumor location impacts immune response in mouse models of colon cancer". Oncotarget 2017; 8:33, 54775-54787.
7Fiegle E, Doleschel D, et al. Dual CTLA-4 and PDL-1 blockade inhibits tumor growth and liver metastasis in a highly aggressive orthotopic mouse model of colon cancer. Neoplasia 2019; 21:9, 932-944
Conéctese
Conversemos
Contáctenos