Autor: Sumithra Urs, PhD | Científica, Desarrollo Científico
Date: January 2019
La leucemia mieloide aguda (LMA) es la neoplasia hematológica más común en adultos y tiene una tasa de sobrevida de 5 años del ~25% luego del diagnóstico.[1] Si bien dos tercios de los pacientes con LMA que reciben tratamientos habituales con altas dosis de quimioterapia alcanzan la remisión, el 50% de los pacientes sufren recidivas de la enfermedad después de la remisión. La mayoría de las recidivas ocurren en un plazo de entre dos y tres años posteriores al tratamiento inicial y cada paciente presenta un riesgo de recivida debido a la heterogeneidad molecular de la enfermedad.[2] Esto ha generado el afán por explorar enfoques terapéuticos novedosos, particularmente las inmunoterapias, ya que las células de la LMA expresan la clase I y II del complejo mayor de histocompatibilidad (CMH), lo cual las convierte en objetivos susceptibles de respuestas inmunes innatas y adquiridas.[3]
In our April 2017 model spotlight, we presented data on preclinical model development of the C1498-Luc-mCherry systemic acute myeloid leukemia model in C57BL/6 mice. La línea es altamente agresiva como modelo diseminado, con un promedio de tiempo de duplicación tumoral de 1,3 días de acuerdo con la imagenología por bioluminiscencia (BLI) y un promedio de sobrevida total de ~23 días. En un esfuerzo constante por ampliar el modelo para aplicaciones inmuno-oncológicas, presentamos aquí datos sobre la respuesta al bloqueo de puntos de control inmunitario.
Distribución de células tumorales C1498-Luc-mCherry
Luego de la inyección intravenosa de células, descubrimos que se desarrollan masas tumorales sólidas en varios tejidos, como los ovarios, el hígado y la columna vertebral. Para comprender la distribución de células tumorales C1498-Luc-mCherry en el modelo, se practicaron citometrías de flujo de bazo y médula ósea y se encontraron tumores en los ovarios o alrededor de los ovarios. Se recogieron muestras de cinco ratones C57BL/6 21 días después del implante de C1498-Luc-mCherry. As the line is a myeloid malignancy it's unsurprising that 97% of the cells analyzed were CD45+ in the tumors around the ovary. We determined, by examination of mCherry, that very few tumor cells were present in the spleen (~2%) and bone marrow (6%) while almost 78% of the CD45+ cells in the ovarian-based tumors were mCherry+ (Fig. 1A). La evaluación histopatológica de las secciones con tinción de H&E de los tumores de ovario confirmó la presencia de poblaciones homogéneas de células neoplásicas con morfología similar. Las masas tumorales estaban compuestas por células tumorales moderadamente pleomórficas con núcleos redondos a oblongos y citoplasma escaso con una gran cantidad de figuras mitóticas (fig. 1B).
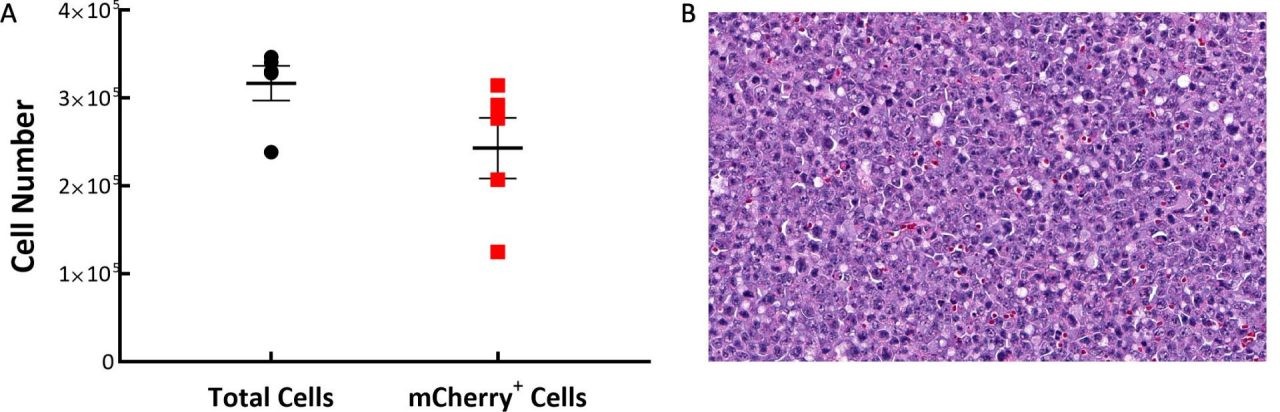
Fig. 1: composición de tumores C1498-Luc-mCherry en ratones C57BL/6. A: los tumores están compuestos principalmente por células mCherry+. B: un corte representativo con tinción de H&E que muestra células neoplásicas con núcleos pleomórficos y varias figuras mitóticas, con un aumento original de 20X.
Respuesta de C1498-Luc-mCherry a la ciclofosfamida
Para confirmar la sensibilidad del modelo tumoral C1498-Luc-mCherry a la ciclofosfamida, probamos el agente quimioterapéutico de amplio espectro que se usa para tratar varios cánceres, incluida la leucemia, en ratones con la enfermedad establecida. El tratamiento con 100 mg/kg generó una regresión completa y un 90% (9/10) de sobrevivientes libres de tumor (TFS, fig. 2). Si bien se observó la remisión, los animales tratados con ciclofosfamida presentaron ovarios y cuernos uterinos agrandados, bazo descolorido y líquido en el peritoneo al momento de la necropsia. Se sabe que la citotoxicidad al tratamiento con ciclofosfamida en pacientes genera varios efectos adversos, como supresión de médula ósea, cistitis hemorrágica, mayor susceptibilidad a infecciones, infertilidad y el riesgo carcinogénico de desarrollar otras neoplasias. La grave toxicidad de la quimioterapia ha ayudado a conducir el camino para explorar enfoques terapéuticos alternativos como las inmunoterapias.
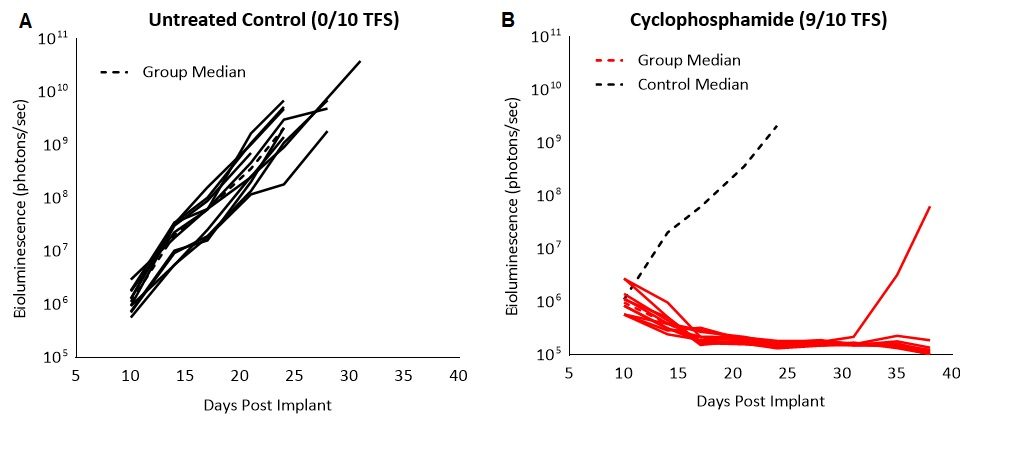
Fig. 2: respuesta de C1498-Luc-mCherry al tratamiento con ciclofosfamida en ratones C57BL/6. A y B: señal por bioluminiscencia de cada ratón individual a lo largo del tiempo. La línea negra de puntos indica la señal promedio de los animales de control sin tratar.
Respuesta de C1498-Luc-mCherry al bloqueo de puntos de control inmunitario
Los datos publicados anteriormente demostraron que el modelo C1498 expresó PD-L1 in vivo y que el bloqueo con el anticuerpo anti-PD-L1 mejoró la sobrevida.[4] En nuestro estudio, evaluamos la respuesta del modelo C1498-Luc-mCherry a los inhibidores de puntos de control inmunitario anti-mPD-1 y anti-mPD-L1 en ratones C57BL/6 con la enfermedad establecida. El tratamiento con anti-mPD-1 o anti-mPD-L1 generó un retraso moderado en el crecimiento tumoral (3 y 5,2 días, respectivamente, sin incluir el valor atípico en el grupo con anti-PD-L1) y una mayor esperanza de vida (25% y 16,7%, respectivamente, fig. 3 y 4). No se observaron efectos adversos sobre el peso corporal relacionados con el tratamiento; sin embargo, la acumulación de ascitis generó distensión abdominal a medida que la enfermedad evolucionó en todos los grupos. La necropsia mostró masas en los ovarios, manchas en el hígado y ganglios linfáticos agrandados.
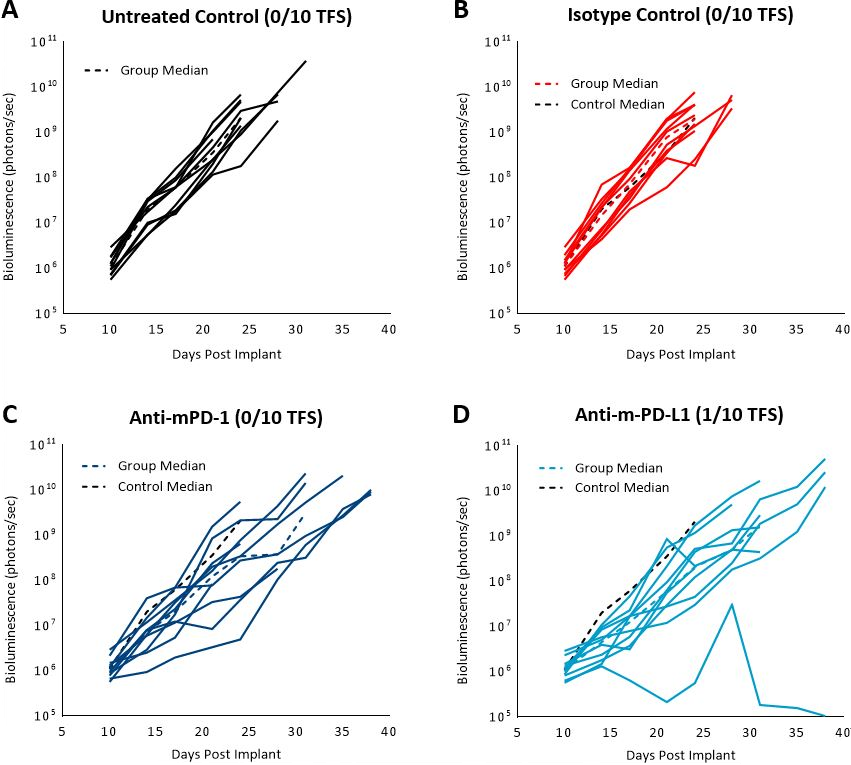
Fig. 3: respuesta de C1498-Luc-mCherry a inhibidores de puntos de control en ratones C57BL/6. A, B, C y D: señal por bioluminiscencia de cada ratón individual a lo largo del tiempo. La línea negra de puntos indica la señal promedio de los animales de control sin tratar. Las líneas de puntos de color indican la señal promedio de cada grupo.
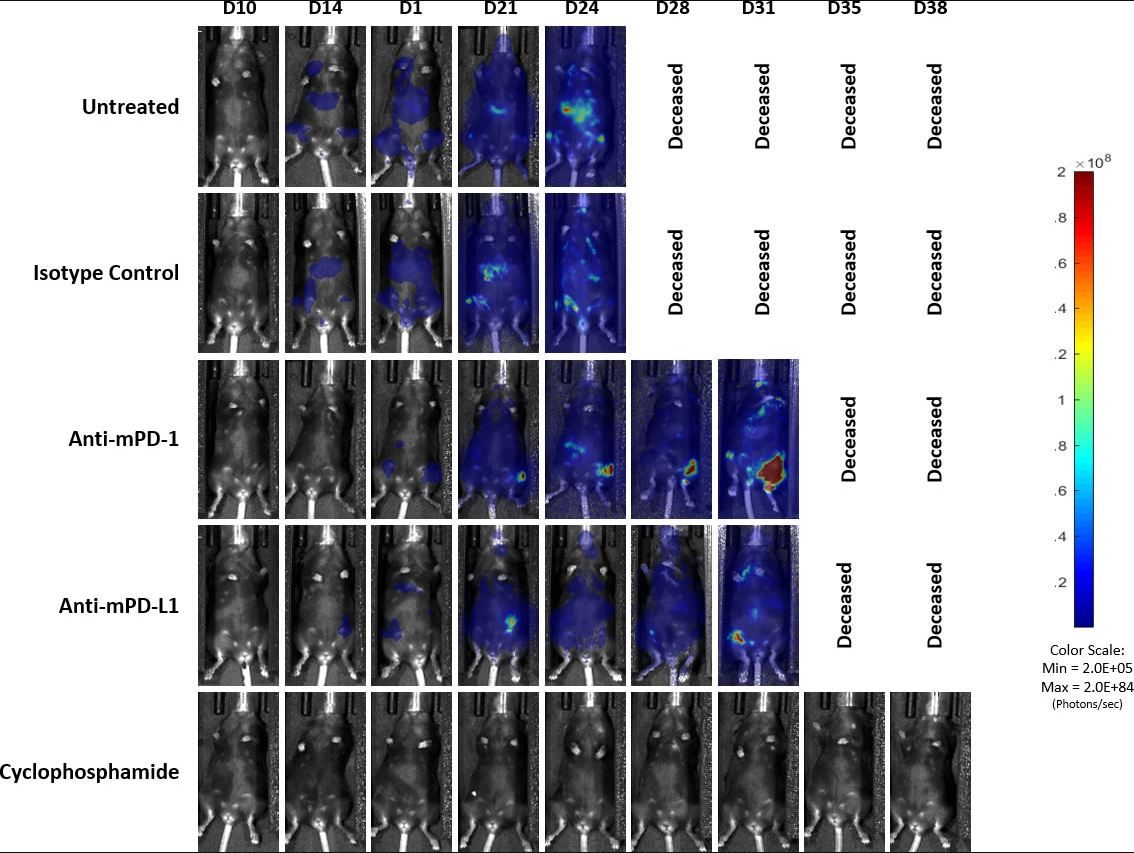
Fig. 4: imágenes representativas de la señal de BLI en el modelo C1498-Luc-mCherry diseminado en ratones C57BL/6
Los informes preliminares de ensayos clínicos de inmunoterapias para la LMA con bloqueo de PD-1/PD-L1 indicaron que solo se observa una respuesta exitosa a los agentes inmunomoduladores, al igual que en muchas formas de cáncer, en subgrupos determinados de pacientes con LMA.[5] En general, la monoterapia con inhibidores de puntos de control inmunitario para la LMA se considera poco efectiva para los pacientes con una enfermedad mayor a la mínima debido a la rápida evolución de la enfermedad, el pequeño marco de respuesta y la heterogeneidad tumoral. Por lo tanto, se está cambiando el enfoque clínico por las terapias combinadas. Como la respuesta a los anticuerpos anti-mPD-1 y anti-mPD-L1 es mínima en este modelo, ofrece amplias oportunidades de investigación preclínica sobre combinaciones farmacológicas novedosas con estos agentes inmunomoduladores.
Contact us today to discuss whether the C1498-Luc-mCherry model is right for your next AML study.
Referencias
2Barrett AJ and Le Blanc K. 2010. Immunotherapy prospects for acute myeloid leukemia. Cli. Exp. Immunol. 161(2); 223-232
3Austin R, Smyth MJ and Lane SW. 2016. Harnessing the immune system in acute myeloid leukemia. Crit. Rev. Oncol. Hematol. 103:62-77
4Zhang L, Gajewski TF and Kline J. 2009. PD-1/PD-L1 interactions inhibit antitumor responses in murine acute myeloid leukemia model. Blood, 114:1545-1552
Conéctese
Conversemos
Contáctenos