Author: Sumithra Urs, PhD | Sr. Scientist, Scientific Development
Date: December 2019
Los cánceres de piel incluyen carcinomas de todas las capas de la piel, siendo los más frecuentes los de células basales (BCC) y los de células escamosas (SCC). Los cánceres de piel con melanoma y sin melanoma (carcinoma de célula Merkel, sarcoma de Kaposi, linfoma cutáneo y otros sarcomas) son mucho menos frecuentes. De todos los tipos de cáncer de piel, el melanoma es una forma grave de cáncer de piel que se inicia en los melanocitos, las células derivadas de la cresta neural que producen la melanina y están en la capa inferior (la stratum basale) de la epidermis. Si bien los BCC y SCC no suelen ser metastásicos, el melanoma maligno menos común, por otro lado, es altamente agresivo y se propaga rápidamente a otras partes del cuerpo. Los melanomas se presentan con muchas formas, tamaños y colores diferentes, y con una variedad de señales de advertencia.[1]
El melanoma se puede curar, cuando se detecta y trata a tiempo, con una tasa de supervivencia de cinco años del 98 por ciento estimada para pacientes de los EE. UU.[2] Una vez que el melanoma invade la piel y otras partes del cuerpo, es más difícil de tratar y puede ser fatal. Los cálculos de la American Cancer Society para melanoma en los Estados Unidos para el 2019 es de unos 192.310 nuevos melanomas diagnosticados, de los cuales 96.480 casos serán invasivos, y se espera que unas 7.230 personas mueran a causa de este cáncer. Los índices de melanoma han ido aumentando rápidamente en las últimas décadas y el melanoma es uno de los tipos de cáncer más común en adultos jóvenes (especialmente mujeres jóvenes). El color de piel claro es uno de los principales factores de riesgo para melanoma que es 20 veces más común en caucásicos que en afroamericanos, aunque ninguna raza es inmune. El riesgo de cada persona puede depender de varios factores que incluyen exposición al sol, luz UV, lunares, cáncer anterior, genética y factores familiares.
Las opciones de tratamiento dependen del estadio de la enfermedad, ubicación del tumor y la salud del paciente en general, e incluyen extirpación quirúrgica del melanoma, inmunoterapia, terapia focalizada, quimioterapia y radiación. Las terapias de un solo agente que se usan normalmente atacan mutaciones en el gen B-RAF, el gen C-KIT y otros genes anormales. Además se pueden utilizar agentes de quimioterapia como dacarbazina, temozolomida, nab-paclitaxel, cisplatina y carboplatina. En este momento se están haciendo ensayos clínicos con agentes de inmunoterapia como IL-2, ipilimumab (inhibidor de CTLA-4) y pembrolizumab y nivolumab (inhibidores de PD-1) y se están reclutando pacientes. Estos fármacos inmunomodulares también se están probando en combinación y con métodos neoadyuvantes. Además se están probando vacunas contra el melanoma, vacunas BCG para melanomas en estadio III y virus oncolíticos (T-VEC).[3] Las nuevas opciones de tratamiento se enfocan en mejorar la calidad de vida y elevar las tasas de supervivencia para los pacientes con melanoma avanzado.
El modelo de melanoma B16 murino es el modelo de melanoma metastásico más usado para estudios preclínicos. We have established the syngeneic B16-F10 model to evaluate responses to immuno-oncology agents and support development of novel therapeutics. La línea celular B16-F10 se generó como subclon de 10.o pasaje seriado de la línea tumoral matriz B16 en ratones C57BL/6.[4] In vitro, estas células crecen como una población adherente que adopta una morfología epitelial. In vivo, el implante intradérmico de células B16-F10 en ratones C57BL/6 tiene como resultado tumores que crecen agresivamente. Nuestros estudios de crecimiento muestran una cinética de crecimiento eficiente tras una variedad de inóculos con un tiempo de duplicación de aproximadamente 2 a 3 días (imagen 1). Los animales de control se mantienen en estudio por 20 a 25 días antes de alcanzar los criterios de eutanasia por carga tumoral excesiva. Esto resulta en un modelo que puede facilitar un período de dosificación de hasta dos semanas de agentes de prueba, para provocar actividad antitumoral. Si bien el modelo en sí no presenta reducción de peso corporal, la formación de costras y ulceraciones en el tumor son síntomas clínicos comunes asociados al crecimiento tumoral de B16-F10 subcutáneo e intradérmico.
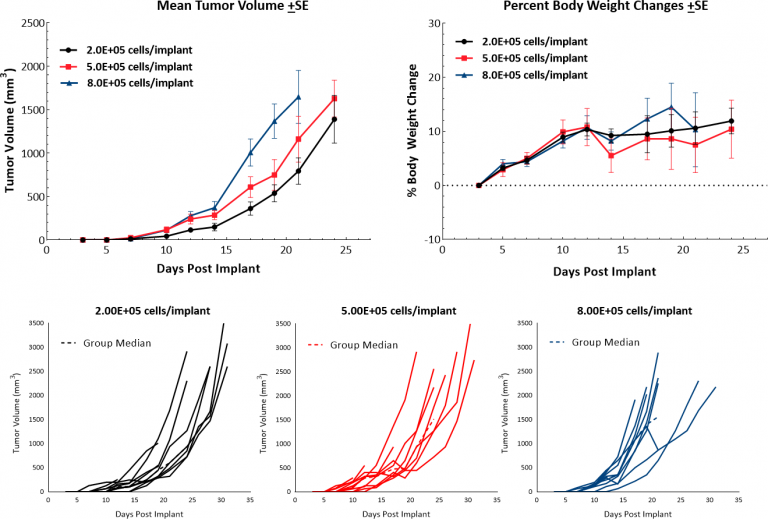
Figura 1: cinética de crecimiento y cambio en el peso corporal tras implante intradérmico de B16-F10 en ratones C57BL/6.
Perfil inmune del tumor B16-F10
Baseline immune profiling of B16-F10 tumor infiltrates was determined by flow cytometry on 5 untreated tumors (300-500mm3) and analyzed using the CompLeukocyteTM package. The immune cell infiltration in the tumor microenvironment, represented a percent of CD45+ cells, showed a distinct immune cell population dominated mostly by undefined CD11b+ myeloid cells characteristic to this tumor model (Fig 2). Las poblaciones de MAT M2 (19%), CSDM-G (15%) y CSDM-M (11%) estuvieron representadas en medidas relativamente proporcionales mientras que las poblaciones de MAT M1 (1,4%) células dendríticas (4%) estuvieron mínimamente representadas. La población linfoide estuvo en su mayoría compuesta por células B (7,3%) y NK (4%) con infiltración mínima de células T en los tumores. El perfil inmune general sugiere un modelo no inmunogénico.
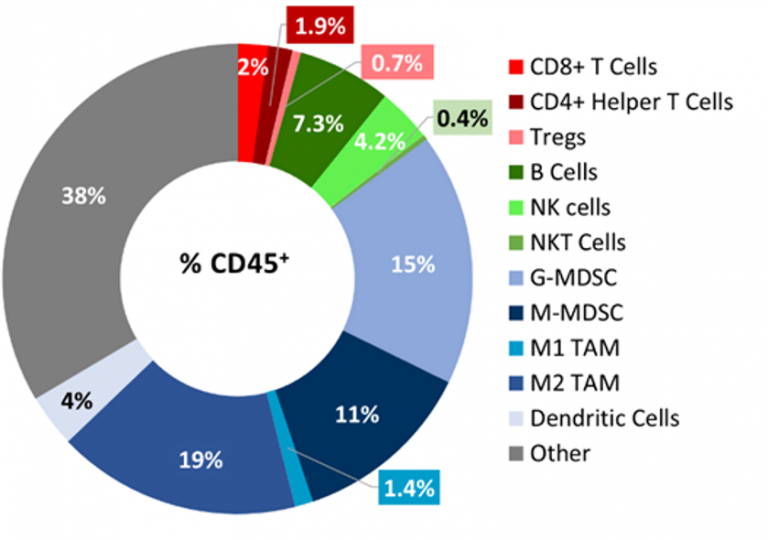
Figura 2: inmunofenotipicación de infiltrados de células tumorales inmunes en el modelo B16-F10.
Respuesta del B16-F10 a la terapia
Inmunomoduladores:
We have investigated a number of immune modulatory antibodies in this model. La iniciación del tratamiento cuando los tumores alcanzaron los ~90 mm3 con inhibidores de puntos de control anti-mPD-1 o anti-mPD-L1 no produjo ninguna respuesta en tumores B16-F10 subcutáneos (imagen 3A). De manera similar, la iniciación del tratamiento con anti-mCTLA-4 o anti-mLAG-3 a partir de los cuatro días después del implante no produjo ninguna respuesta (imagen 3A). Por último, tampoco se detectó ninguna actividad antitumoral cuando los tumores B16-F10 se trataron con receptor coestimulador CD137 de la familia de receptores TNF (imagen 3B). Dado el microambiente tumoral inmunosupresor de los tumores B16-F10 vírgenes, no es ninguna sorpresa que los inmunomoduladores de un solo agente provocaron una respuesta limitada/ninguna respuesta, y esta falta de respuesta sugiere un modelo tumoral inmunológicamente frío, como se ha reportado para el B16-F10.
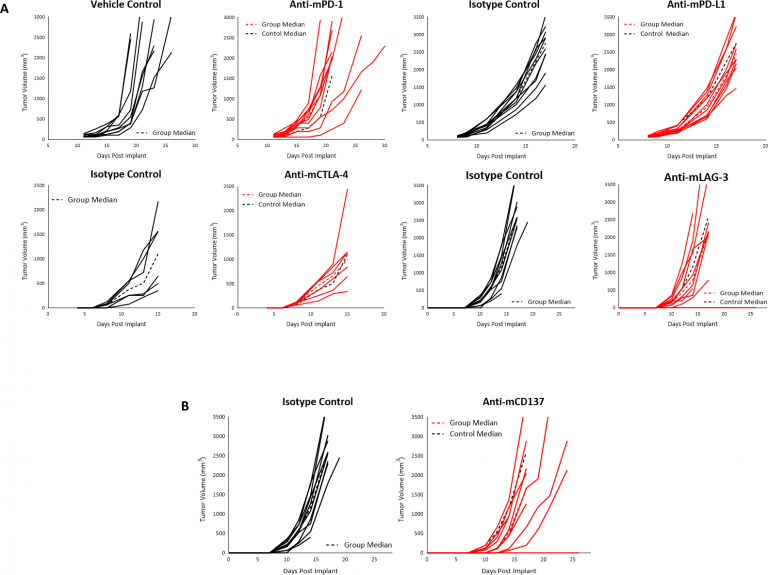
Figura 3: respuesta de tumores B16-F10 tras tratamiento con inhibidores de puntos de control (A) o Anti-mCD137 (B) en ratones C57BL/6.
Radiación:
La radioterapia (RT) se usa en casos de melanoma en los que los pacientes no son buenos candidatos para una cirugía o se niegan a recibir un tratamiento quirúrgico. Evaluamos la sensibilidad de tumores B16-F10 subcutáneos a una sola dosis de radiación focalizada administrada con la Small Animal Radiation Research Platform (SARRP) de Xstrahl. El tratamiento con radiación de 10, 15 o 20 Gy mostró actividad antitumoral en al menos el 50% de los animales, dando como resultado un retraso en el crecimiento tumoral en respuesta a la dosis de 5.9, 14 o 10,5 días para dosis de RT de 10, 15 y 20 Gy respectivamente, lo que indica que el modelo de melanoma B16-F10 responde a la radiación (imagen 4). Sin embargo, incluso con el tratamiento con la dosis mayor probada no se obtuvo una regresión significativa ni quedaron sobrevivientes en los que el tumor haya desaparecido. Por tanto, la utilización de RT focalizada a través SARRP en el entorno preclínico podría ser útil para evaluar métodos combinados y simular vías de desarrollo clínico que incluyan tratamiento con radiación.
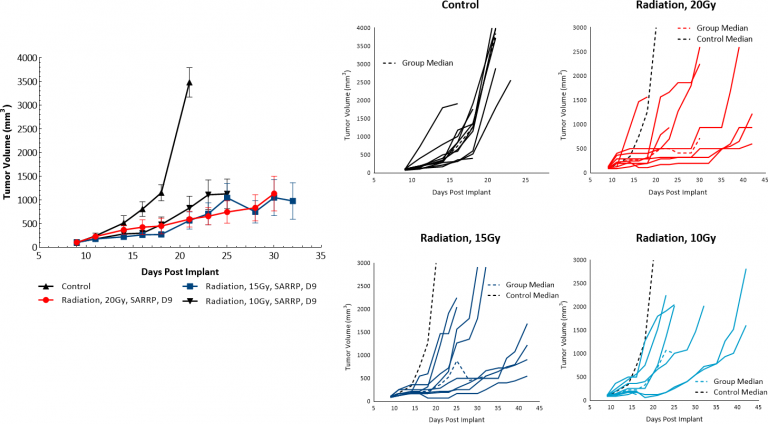
Figura 4: respuesta de tumores B16-F10 a radiación focalizada en ratones C57BL/6.
Las opciones de tratamiento para pacientes con melanoma donde se usen métodos combinados con agentes inmunomodeladores y quimioterapia o radioterapia son posibles vías para mejorar la respuesta del paciente.[5] Además, un tratamiento combinado podría contribuir a alterar la naturaleza inmunológicamente fría del tumor para dar lugar a un microambiente tumoral más receptivo/sensible que respondería mejor a la terapia. To discuss how the B16-F10 model would be useful in your next immunotherapy study, contact the scientists.
Referencias
1https://www.skincancer.org/skin-cancer-information/melanoma/melanoma-warning-signs-and-images/.
2SEER Cancer Stat Facts. National Cancer Institute, NIH (https://www.cancer.gov).
3 NCI melanoma clinical trials (https://www.cancer.gov/about-cancer/treatment/clinical-trials/disease/melanoma).
4 Nakamura K et al. "Characterization of mouse melanoma cell lines by their mortal malignancy using an experimental metastatic model". Life Sci. Ene. de 2002; 4;70(7):791-8. DOI: 10,1/s0024-3205(01)01454-0.
5 Schwartz AL et al. "Antisense targeting of CD47 enhances human cytotoxic T-cell activity and increases survival of mice bearing B16 melanoma when combined with anti-CTLA4 and tumor irradiation". Cancer Immunol Immunother. 18 de oct. de 2019. DOI: 10,1/s00262-019-02397-7.
Conéctese
Conversemos
Contáctenos