Date: July 2018
En este artículo destacado sobre tecnología presentamos los principios de recuento absoluto y las ventajas de este servicio cuando se usa en combinación con análisis inmunofenotípico tumoral.
El recuento absoluto es una aplicación que permite a los científicos que trabajan con citometría de flujo cuantificar la cantidad total de células en el tejido y se puede usar para medir la infiltración en células inmunes en un tumor. En este artículo destacado sobre tecnología presentamos los principios de recuento absoluto y las ventajas de este servicio cuando se usa en combinación con análisis inmunofenotípico tumoral.
La capacidad de medir con precisión los cambios dinámicos en la respuesta inmune dentro del microambiente tumoral (MAT) es fundamental al probar nuevas terapias inmunomoduladoras. Mientras que la configuración de paneles de inmunotipificación robustos es necesaria para definir subgrupos con precisión, el método con el que se reportan estos parámetros puede afectar cómo se interpretan los datos en última instancia. Una lectura común es "% de células CD45+" que mide la distribución relativa de cada subgrupo como un porcentaje de células inmunes totales.1,2 Este método es valioso porque ayuda a cuantificar el efecto que tiene la terapia en la proporción de subgrupos con diferentes actividades pro y antitumorales. Por ejemplo, un aumento en la proporción de células T CD8+ con una disminución correspondiente en las células T reguladoras indica que el tratamiento ha reducido la inmunosupresión mediada por células T reguladoras en el MAT.
No obstante, el uso de mediciones de distribución como única lectura tiene limitaciones. Esto se demuestra en el ejemplo de abajo. En este estudio se trataron ratones con tumores CT26 con un inhibidor de puntos de control anti-mCTLA-4 y se observó una marcada inhibición del crecimiento tumoral (imagen 1). Para examinar el mecanismo de acción, primero usamos citometría de flujo para perfilar la distribución de células CD3+ y CD11b+ derivadas del tumor (células T y células mieloides, respectivamente) entre el total de células CD45+ (ver imagen 2). A partir de estos datos, el intérprete podría llegar a la conclusión de el bloqueo de CTLA-4 produjo tanto un aumento en la cantidad de células T como una reducción simultánea en células mieloides. Esto sugeriría que la actividad mecanística del tratamiento está mediada por una expansión en la cantidad de células T CD8+ antitumorales así como también una contracción de las células mieloides inmunosupresoras. Como se demuestra abajo, esta conclusión sería incorrecta.
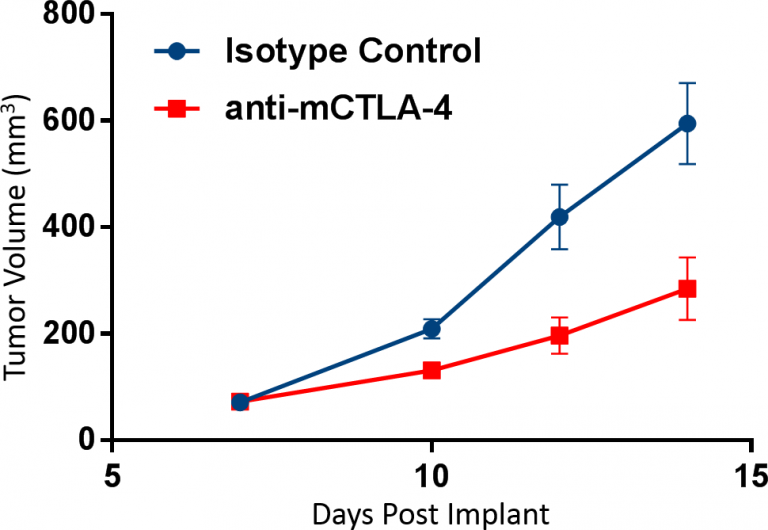
Imagen 1: Se implantaron células CT26 subcutáneamente en la axila derecha de ratones Balb/c. La dosificación de n=10 animales/grupo se inició cuando los tumores estaban establecidos y se monitoreó la evolución del tumor mediante mediciones de calibre. Las dosis de anticuerpos se administraron dos veces por semana antes de la toma de muestras el día 14.
El cálculo en tándem de recuentos absolutos se suele usar para superar la limitación descrita arriba. Este parámetro mide con precisión la infiltración de los subgrupos celulares en los tumores y en general se reporta como cantidad total de células por unidad de masa.3,4,5 Cuando se agregan los recuentos absolutos al estudio de arriba queda claro que de hecho el recuento total de células mieloides/gramo de tumo no cambió tras la terapia con anti-mCTLA-4 (imagen 2). En cambio, la disminución observada en la proporción de células mieloides es más probablemente a causa del aumento demostrado en la cantidad absoluta de células T. El mensaje que rescatamos es que cuando la terapia desencadena un cambio en distribución de un subgrupo objetivo, no necesariamente se debe a un cambio en las cifras absolutas de dicho subgrupo celular sino que puede ocurrir como consecuencia de la expansión o contracción de un subgrupo diferente.
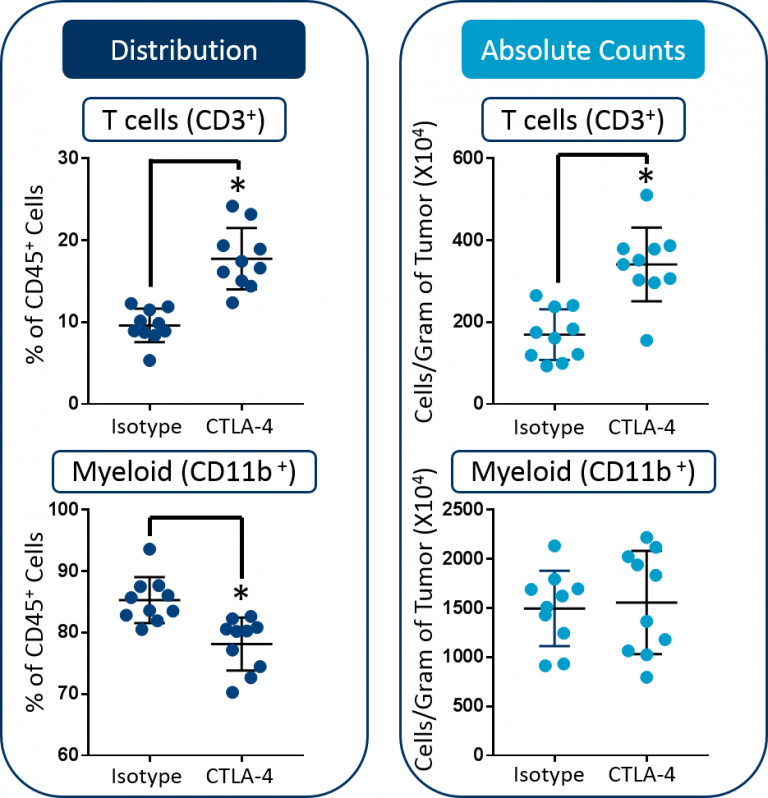
Imagen 2: Mediciones de distribución vs. recuento absoluto de células T y células mieloides en tumores CT26. Se hizo un análisis estadístico usando una prueba t de Student (*p<0,05).
El análisis inmunofenotípico subsiguiente de macrófagos asociados a tumores (MAT) y subgrupos de células T enfatiza aún más el valor de incluir parámetros de recuento absoluto. Como se muestra en la imagen 3, si bien el análisis reveló que la proporción de MAT M2 disminuyó en el tumor, no hubo ningún cambio en los recuentos absolutos. Por lo tanto, contrario al análisis inicial, los recuentos absolutos no indican que la farmacodinámica de MAT M2 contribuye a la eficacia general en este estudio. Y esta es una conclusión más fiable basada en los datos disponibles. Por último, la terapia con anti-mCTLA-4 produjo un aumento en las cifras absolutas tanto de células T CD8+ como de células T auxiliares CD4+. En conjunto, estos datos demuestran cómo los recuentos absolutos pueden ser esenciales para cuantificar correctamente la cantidad total de células para subgrupos derivados de tejidos.
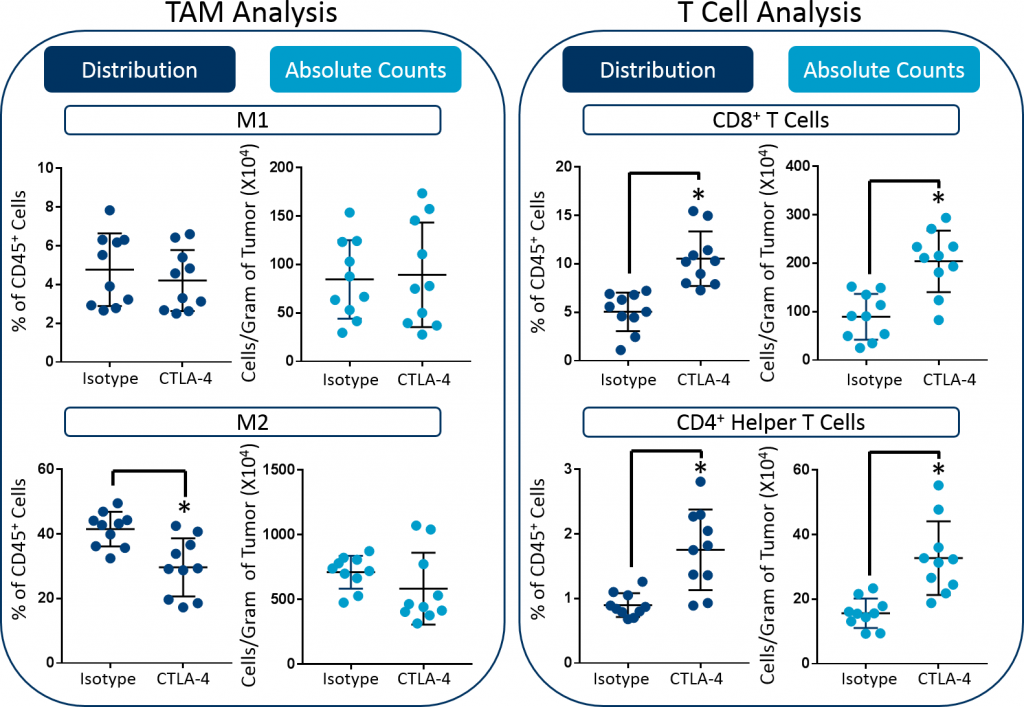
Imagen 3: Mediciones de distribución vs. recuento absoluto de MAT M1 y M2, células T CD8+ y células auxiliares CD4+ en tumores CT26. Se hizo un análisis estadístico usando una prueba t de Student (*p<0,05).
Metodología de recuento absoluto
El análisis inmunofenotípico subsiguiente de macrófagos asociados a tumores (MAT) y subgrupos de células T enfatiza aún más el valor de incluir parámetros de recuento absoluto. Como se muestra en la imagen 3, si bien el análisis reveló que la proporción de MAT M2 disminuyó en el tumor, no hubo ningún cambio en los recuentos absolutos. Por lo tanto, contrario al análisis inicial, los recuentos absolutos no indican que la farmacodinámica de MAT M2 contribuye a la eficacia general en este estudio. Y esta es una conclusión más fiable basada en los datos disponibles. Por último, la terapia con anti-mCTLA-4 produjo un aumento en las cifras absolutas tanto de células T CD8+ como de células T auxiliares CD4+. En conjunto, estos datos demuestran cómo los recuentos absolutos pueden ser esenciales para cuantificar correctamente la cantidad total de células para subgrupos derivados de tejidos.
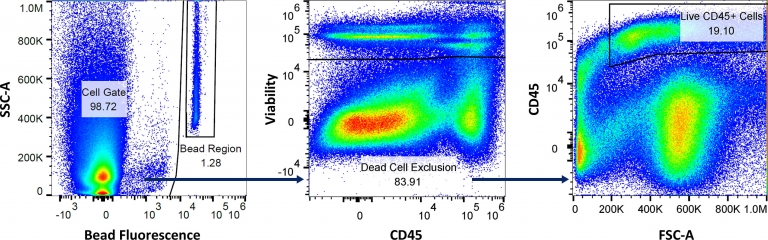
Fig. 4: Gating strategy to measure the volume of sample aspirated, absolute counts of total live cells, and live CD45+ cells, using the absolute counting flow panel.
La imagen 4 ilustra cómo se calculan los recuentos absolutos de células. La región de microesferas cuantifica la cantidad de microesferas adquiridas por el citómetro de flujo para medir el volumen de muestra que se aspira. El gate celular se analiza usando un tinte de viabilidad, que excluye las células muertas. Y después de la exlcusión de células muertas, se mide la expresión de CD45 para calcular el porcentaje de células que entran en el gate de células CD45+ vivas. Luego se calcula cantidad total de células inmunes CD45+ detectadas por el citómetro usando la formula de abajo. Por último, como se conoce la masa tumoral inicial, se puede volver a calcular el recuento de células/gramo del tumor.
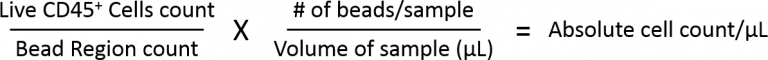
El conjunto de datos completo para estudio de arriba está disponible a pedido. Describe los efectos de bloqueo de puntos de control en los recuentos y perfila los siguientes subgrupos en tumores CT26; así como también los paneles de flujo que se usaron para hacer estas mediciones.
Células supresoras derivadas de mieloides granulocíticas
Células supresoras derivadas de mieloides monocíticas
Células dendríticas
Macrófagos asociados a tumores (M1 y M2)
Células B
Células exterminadoras naturales
Células T exterminadoras naturales
Células T CD8+
Células T auxiliares CD4+
Células T reguladoras
Contact the scientists at Labcorp to request the full data set or to learn more about our absolute counting service and how it can be applied to your preclinical research.
Referencias
1Kadić, Elma, et al. "Effect of cryopreservation on delineation of immune cell subpopulations in tumor specimens as determined by multiparametric single cell mass cytometry analysis". BMC immunology 18,1 (2017): 6.
2Lewis, Katherine E., et al. "Interleukin-21 combined with PD-1 or CTLA-4 blockade enhances antitumor immunity in mouse tumor models". Oncoimmunology 7,1 (2018): e1377873.
3Muroyama, Yuki, et al. "Stereotactic radiotherapy increases functionally suppressive regulatory T cells in the tumor microenvironment". Cancer immunology research 5,11 (2017): 992.
4Balza, Enrica, et al. “The therapeutic T‐cell response induced by tumor delivery of TNF and melphalan is dependent on early triggering of natural killer and dendritic cells.” European journal of immunology 47,4 (2017): 743-753.
Conéctese
Conversemos
Contáctenos